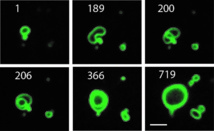
Secuencia de crecimiento de las células artificiales (el tiempo está mostrado en minutos). Imagen: Michael Hardy. Fuente: Universidad de California en San Diego.
No es la primera vez que los científicos logran crear en un laboratorio células sintéticas que emulen la actividad de células vivas. Con esta técnica se han creado tejidos musculares, sistemas de ingeniería biocomputacional, pulmones o glóbulos rojos.
En todos estos trabajos, sin embargo, faltaba algo. El objetivo ha sido siempre replicar células que no solo tengan las mismas funciones que las producidas por los organismos vivos, sino que también puedan crecer y desarrollarse como éstas.
Un equipo de investigadores de la Universidad de California en San Diego, formado por biólogos y científicos, ha encontrado una respuesta a esta búsqueda en un nuevo modelo de membrana celular artificial capaz de crecer de manera continua al añadir nuevos fosfolípidos a su estructura, según informa la citada universidad en un comunicado.
Membranas de fosfolípidos
El estudio, que se ha publicado esta semana en la revista Proceedings of the National Academy of Sciences, va a permitir recrear de manera más fiel el comportamiento de las células vivas, pues los modelos que se utilizaban hasta ahora no tenían esa capacidad de crecimiento mediante fosfolípidos.
“Muchos otros científicos han indagado en la habilidad de los lípidos para constituir por sí mismos vesículas bicapas con propiedades que recuerdan a las de las células vivas, pero hasta ahora nadie había sido capaz de imitar la capacidad que tienen estas para mantener una formación constante de membranas de fosfolípidos”, afirma Neal Devaraj, profesor ayudante de Química y Bioquímica en la Universidad de California en San Diego y líder del equipo de investigación, que destaca que su modelo “sintetiza de manera continua todos los componentes necesarios para formar membranas catalíticas adicionales”.
Para Devaraj, el gran avance de estas membranas es que “a pesar de ser completamente sintéticas, pueden imitar las características de organismos vivos más complejos, como su capacidad para adaptar su composición respondiendo a factores ambientales”.
En todos estos trabajos, sin embargo, faltaba algo. El objetivo ha sido siempre replicar células que no solo tengan las mismas funciones que las producidas por los organismos vivos, sino que también puedan crecer y desarrollarse como éstas.
Un equipo de investigadores de la Universidad de California en San Diego, formado por biólogos y científicos, ha encontrado una respuesta a esta búsqueda en un nuevo modelo de membrana celular artificial capaz de crecer de manera continua al añadir nuevos fosfolípidos a su estructura, según informa la citada universidad en un comunicado.
Membranas de fosfolípidos
El estudio, que se ha publicado esta semana en la revista Proceedings of the National Academy of Sciences, va a permitir recrear de manera más fiel el comportamiento de las células vivas, pues los modelos que se utilizaban hasta ahora no tenían esa capacidad de crecimiento mediante fosfolípidos.
“Muchos otros científicos han indagado en la habilidad de los lípidos para constituir por sí mismos vesículas bicapas con propiedades que recuerdan a las de las células vivas, pero hasta ahora nadie había sido capaz de imitar la capacidad que tienen estas para mantener una formación constante de membranas de fosfolípidos”, afirma Neal Devaraj, profesor ayudante de Química y Bioquímica en la Universidad de California en San Diego y líder del equipo de investigación, que destaca que su modelo “sintetiza de manera continua todos los componentes necesarios para formar membranas catalíticas adicionales”.
Para Devaraj, el gran avance de estas membranas es que “a pesar de ser completamente sintéticas, pueden imitar las características de organismos vivos más complejos, como su capacidad para adaptar su composición respondiendo a factores ambientales”.
De lo simple a lo complejo
Con ello, el equipo ha demostrado que una creación molecular artificial es capaz de transformar construcciones celulares simples en estructuras más complejas. Esa es, de hecho, la base del estudio, que utiliza autocatalizadores sintéticos para sustituir las redes bioquímicas naturales, “transformando componentes simples y de gran energía en membranas artificiales”.
“Los resultados”, dice Devaraj, “nos hacen ver que a partir de componentes químicos simples pueden surgir membranas lipídicas complejas capaces de sintetizarse de manera indefinida sin intervención externa”.
El desarrollo que ha realizado el equipo no deja de recordar a algunos al Juego de la Vida de Conway, en su demostración de cómo los sistemas de organismos vivos más complejos parten de unos bloques básicos. Como apunta ya el equipo, este estudio podría ser un paso adelante en la investigación no solo de nuevas herramientas para la biología sintética, sino también del origen de la vida.
Con ello, el equipo ha demostrado que una creación molecular artificial es capaz de transformar construcciones celulares simples en estructuras más complejas. Esa es, de hecho, la base del estudio, que utiliza autocatalizadores sintéticos para sustituir las redes bioquímicas naturales, “transformando componentes simples y de gran energía en membranas artificiales”.
“Los resultados”, dice Devaraj, “nos hacen ver que a partir de componentes químicos simples pueden surgir membranas lipídicas complejas capaces de sintetizarse de manera indefinida sin intervención externa”.
El desarrollo que ha realizado el equipo no deja de recordar a algunos al Juego de la Vida de Conway, en su demostración de cómo los sistemas de organismos vivos más complejos parten de unos bloques básicos. Como apunta ya el equipo, este estudio podría ser un paso adelante en la investigación no solo de nuevas herramientas para la biología sintética, sino también del origen de la vida.
Referencia bibliográfica:
Michael D. Hardy, Jun Yang, Jangir Selimkhanov, Christian M. Cole, Lev S. Tsimring, and Neal K. Devaraj. Self-reproducing catalyst drives repeated phospholipid synthesis and membrane growth. Proceedings of the National Academy of Sciences (22 de junio de 2015). DOI: 10.1073/pnas.1506704112.
Michael D. Hardy, Jun Yang, Jangir Selimkhanov, Christian M. Cole, Lev S. Tsimring, and Neal K. Devaraj. Self-reproducing catalyst drives repeated phospholipid synthesis and membrane growth. Proceedings of the National Academy of Sciences (22 de junio de 2015). DOI: 10.1073/pnas.1506704112.

 Tendencias Científicas
Tendencias Científicas

 Los electrones abren un nuevo mundo a la física cuántica
Los electrones abren un nuevo mundo a la física cuántica CIENCIA ON LINE
CIENCIA ON LINE