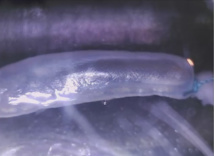
Prueba de resistencia mecánica en el órgano sin células que consiste en 10.000 ciclos de hinchado y deshinchado durante 72 horas. Fuente: Nature Communications.
Investigadores del Instituto Karolinska (Suecia) han implantado en el esófago de ratas un injerto capaz de resistir el estrés mecánico. “Hemos reemplazado todo el esófago cervical mediante ingeniería de tejidos”, indica a Sinc Paolo Macchiarini, autor principal del estudio.
El trabajo, publicado en la revista Nature Communications, supone un nuevo paso hacia el desarrollo de técnicas de bioingeniería capaces de reemplazar esófagos dañados. Cada año, numerosas personas se someten a procedimientos quirúrgicos que eliminan ciertas zonas del esófago alteradas por cáncer, traumas o defectos al nacer.
Los expertos aseguran que la mayoría de los procesos quirúrgicos actuales relacionados con este conducto son complejos y pueden provocar complicaciones, pérdida de peso y mortalidad. La razón es que este tipo de intervención reemplaza el esófago dañado con partes del intestino o del estómago del propio paciente.
Así, “un nuevo injerto creado mediante ingeniería eliminaría la necesidad de utilizar tejido del propio paciente y mejoraría los resultados de la cirugía”, sostiene Macchiarini.
“Muchos de los pacientes que se someten a la cirugía sufren de disfagia (problemas para la deglución) años después de la operación”, añade el investigador italiano. “Por eso, pensamos que esta nueva técnica mejoraría la calidad de vida de los pacientes”.
Para ello, los autores extrajeron un trozo de esófago de una rata donante. A esta sección se le eliminaron las células, creando un andamiaje biocompatible que retenía las propiedades mecánicas y bioactivas del órgano.
Esta estructura hueca fue ‘sembrada’ con un tipo de células madre de la médula ósea llamadas mesenquimatosas. En tres semanas se formó el nuevo tejido y este reemplazó el 20% del esófago de la rata receptora –perteneciente a la zona cervical–.
“El injerto funcionó mejor de lo esperado. Una complicación típica de la cirugía de esófago es la aparición de fugas o estenosis [estrechamientos] y no vimos ninguna al usar este método”, sostiene Macchiarini.
El trabajo, publicado en la revista Nature Communications, supone un nuevo paso hacia el desarrollo de técnicas de bioingeniería capaces de reemplazar esófagos dañados. Cada año, numerosas personas se someten a procedimientos quirúrgicos que eliminan ciertas zonas del esófago alteradas por cáncer, traumas o defectos al nacer.
Los expertos aseguran que la mayoría de los procesos quirúrgicos actuales relacionados con este conducto son complejos y pueden provocar complicaciones, pérdida de peso y mortalidad. La razón es que este tipo de intervención reemplaza el esófago dañado con partes del intestino o del estómago del propio paciente.
Así, “un nuevo injerto creado mediante ingeniería eliminaría la necesidad de utilizar tejido del propio paciente y mejoraría los resultados de la cirugía”, sostiene Macchiarini.
“Muchos de los pacientes que se someten a la cirugía sufren de disfagia (problemas para la deglución) años después de la operación”, añade el investigador italiano. “Por eso, pensamos que esta nueva técnica mejoraría la calidad de vida de los pacientes”.
Para ello, los autores extrajeron un trozo de esófago de una rata donante. A esta sección se le eliminaron las células, creando un andamiaje biocompatible que retenía las propiedades mecánicas y bioactivas del órgano.
Esta estructura hueca fue ‘sembrada’ con un tipo de células madre de la médula ósea llamadas mesenquimatosas. En tres semanas se formó el nuevo tejido y este reemplazó el 20% del esófago de la rata receptora –perteneciente a la zona cervical–.
“El injerto funcionó mejor de lo esperado. Una complicación típica de la cirugía de esófago es la aparición de fugas o estenosis [estrechamientos] y no vimos ninguna al usar este método”, sostiene Macchiarini.
Después de la operación
El equipo sueco monitorizó las ratas durante dos semanas y, aunque al principio permanecían inmóviles, estos roedores se recuperaron rápidamente y no mostraron signos de dolor, deterioro de la salud, rechazo del órgano ni ninguna respuesta inmune adversa.
Además, los investigadores percibieron el crecimiento de nuevos vasos sanguíneos y de fibras musculares alrededor del injerto. Según ellos, una dieta líquida y blanda –característica de la poscirugía– fue clave en la recuperación del peso normal de los pequeños mamíferos.
“Todos las ratas aceptaron el injerto pero el problema principal fue optimizar el posoperatorio. Al principio tuvimos problemas, se rompían las anastomosis –suturas– con la comida sólida. Finalmente encontramos que la dieta líquida era necesaria durante los primeros días para aliviar las soldaduras del estrés físico”, señala el científico del Karolinska.
Los autores advierten que una limitación de este estudio es que el trasplante de solo un 20% de este conducto del tracto digestivo podría no bastar para la práctica clínica, y que el éxito del implante debería ser examinado durante periodos más largos.
Sin embargo, “este tipo de trabajo sirve de guía para la evaluación en modelos animales mayores donde la sustitución del total del esófago y el seguimiento a largo plazo son factibles”, señalan.
“Actualmente estamos comparando la dinámica que hay in vivo con las condiciones que creamos en el cultivo celular. Más adelante vamos a investigar la viabilidad de utilizar este método en el tejido esofágico de animales más grandes y en humanos”, concluye Macchiarini.
El equipo sueco monitorizó las ratas durante dos semanas y, aunque al principio permanecían inmóviles, estos roedores se recuperaron rápidamente y no mostraron signos de dolor, deterioro de la salud, rechazo del órgano ni ninguna respuesta inmune adversa.
Además, los investigadores percibieron el crecimiento de nuevos vasos sanguíneos y de fibras musculares alrededor del injerto. Según ellos, una dieta líquida y blanda –característica de la poscirugía– fue clave en la recuperación del peso normal de los pequeños mamíferos.
“Todos las ratas aceptaron el injerto pero el problema principal fue optimizar el posoperatorio. Al principio tuvimos problemas, se rompían las anastomosis –suturas– con la comida sólida. Finalmente encontramos que la dieta líquida era necesaria durante los primeros días para aliviar las soldaduras del estrés físico”, señala el científico del Karolinska.
Los autores advierten que una limitación de este estudio es que el trasplante de solo un 20% de este conducto del tracto digestivo podría no bastar para la práctica clínica, y que el éxito del implante debería ser examinado durante periodos más largos.
Sin embargo, “este tipo de trabajo sirve de guía para la evaluación en modelos animales mayores donde la sustitución del total del esófago y el seguimiento a largo plazo son factibles”, señalan.
“Actualmente estamos comparando la dinámica que hay in vivo con las condiciones que creamos en el cultivo celular. Más adelante vamos a investigar la viabilidad de utilizar este método en el tejido esofágico de animales más grandes y en humanos”, concluye Macchiarini.
Referencia bibliográfica:
Sebastian Sjöqvist et al.: Experimental orthotopic transplantation of a tissue-engineered oesophagus in rats. Nature Communications (2014). DOI: 10.1038/ncomms4562.
Sebastian Sjöqvist et al.: Experimental orthotopic transplantation of a tissue-engineered oesophagus in rats. Nature Communications (2014). DOI: 10.1038/ncomms4562.

 Tendencias Científicas
Tendencias Científicas

 El corazón débil también daña al cerebro
El corazón débil también daña al cerebro CIENCIA ON LINE
CIENCIA ON LINE