Investigadores de la Universidad de Carolina del Norte (UNC, EE.UU.) han transformado células de la piel de ratones en células madre caza-cánceres, que destruyen los tumores cerebrales conocidos como glioblastomas.
La técnica, publicada en Nature Communications, se basa en la versión más reciente de la tecnología que ganó el Premio Nobel de 2007, que permite convertir células de la piel en células madre similares a las embrionarias.
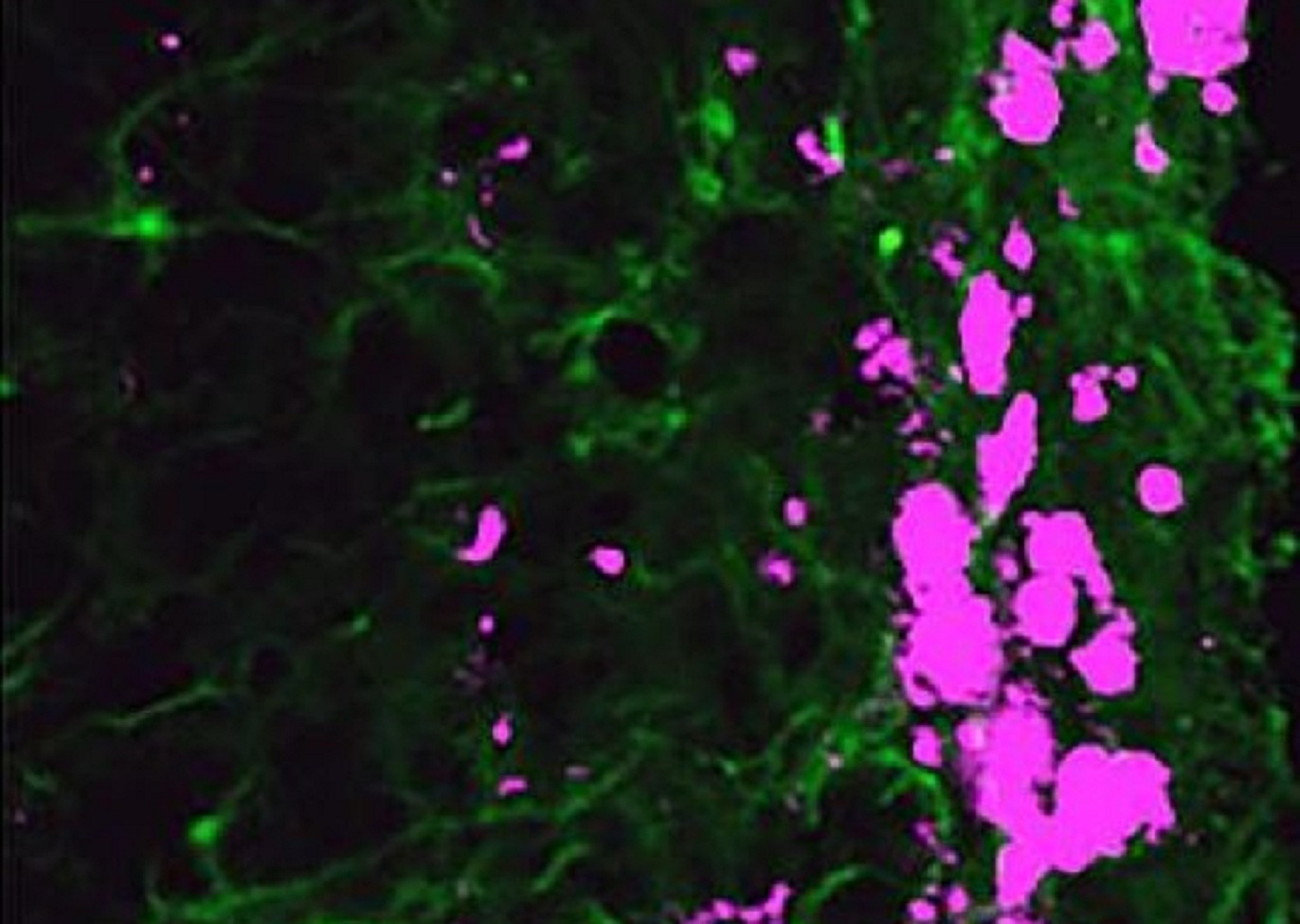
En su trabajo, Shawn Hingtgen y su equipo de la Escuela de Farmacia, reprogramaron células de la piel conocidas como fibroblastos -que producen colágeno y tejido conectivo- para convertirlas en células madre neuronales inducidas. Trabajando con ratones, el equipo de Hingtgen demostró que estas células madre neurales tienen una capacidad innata para moverse por todo el cerebro y para matar las células cancerosas que haya.
El equipo también demostró que estas células madre podían ser manipuladas para producir una proteína que mata tumores, informa la universidad en una nota.
Dependiendo del tipo de tumor, el equipo de la Hingtgen aumentó el tiempo de supervivencia de los ratones entre un 160 y un 220 por ciento. Los siguientes pasos se centrarán en las células madre humanas.
La técnica, publicada en Nature Communications, se basa en la versión más reciente de la tecnología que ganó el Premio Nobel de 2007, que permite convertir células de la piel en células madre similares a las embrionarias.
En su trabajo, Shawn Hingtgen y su equipo de la Escuela de Farmacia, reprogramaron células de la piel conocidas como fibroblastos -que producen colágeno y tejido conectivo- para convertirlas en células madre neuronales inducidas. Trabajando con ratones, el equipo de Hingtgen demostró que estas células madre neurales tienen una capacidad innata para moverse por todo el cerebro y para matar las células cancerosas que haya.
El equipo también demostró que estas células madre podían ser manipuladas para producir una proteína que mata tumores, informa la universidad en una nota.
Dependiendo del tipo de tumor, el equipo de la Hingtgen aumentó el tiempo de supervivencia de los ratones entre un 160 y un 220 por ciento. Los siguientes pasos se centrarán en las células madre humanas.
Otros trabajos
El equipo de Hingtgen también está mejorando actualmente la capacidad de resistencia de las células madre dentro de la cavidad quirúrgica.
Descubrieron que las células madre necesitaban una matriz física para apoyarse y organizarse, y así aguantar el tiempo suficiente para buscar células cancerosas.
"Sin una estructura como esa, las células madre vagan demasiado rápido para hacer algún bien", dice Hingtgen, que ha publicado estel resultado en la revista Biomaterials.
En ese estudio, Hingtgen y su equipo añadieron a sus células madre un sellador de fibrina aprobado comúnmente utilizado como pegamento quirúrgico.
La matriz física que crea triplicó la retención de las células madre en la cavidad quirúrgica, con un mayor apoyo para la aplicabilidad y la fuerza de la técnica.
El equipo de Hingtgen también está mejorando actualmente la capacidad de resistencia de las células madre dentro de la cavidad quirúrgica.
Descubrieron que las células madre necesitaban una matriz física para apoyarse y organizarse, y así aguantar el tiempo suficiente para buscar células cancerosas.
"Sin una estructura como esa, las células madre vagan demasiado rápido para hacer algún bien", dice Hingtgen, que ha publicado estel resultado en la revista Biomaterials.
En ese estudio, Hingtgen y su equipo añadieron a sus células madre un sellador de fibrina aprobado comúnmente utilizado como pegamento quirúrgico.
La matriz física que crea triplicó la retención de las células madre en la cavidad quirúrgica, con un mayor apoyo para la aplicabilidad y la fuerza de la técnica.
Referencia bibliográfica:
Juli R. Bagó, Adolfo Alfonso-Pecchio, Onyi Okolie, Raluca Dumitru, Amanda Rinkenbaugh, Albert S. Baldwin, C. Ryan Miller, Scott T. Magness, Shawn D. Hingtgen: Therapeutically engineered induced neural stem cells are tumour-homing and inhibit progression of glioblastoma. Nature Communications (2016). DOI: 10.1038/ncomms10593.
Juli R. Bagó, Adolfo Alfonso-Pecchio, Onyi Okolie, Raluca Dumitru, Amanda Rinkenbaugh, Albert S. Baldwin, C. Ryan Miller, Scott T. Magness, Shawn D. Hingtgen: Therapeutically engineered induced neural stem cells are tumour-homing and inhibit progression of glioblastoma. Nature Communications (2016). DOI: 10.1038/ncomms10593.

 Tendencias Científicas
Tendencias Científicas

 El corazón débil también daña al cerebro
El corazón débil también daña al cerebro CIENCIA ON LINE
CIENCIA ON LINE