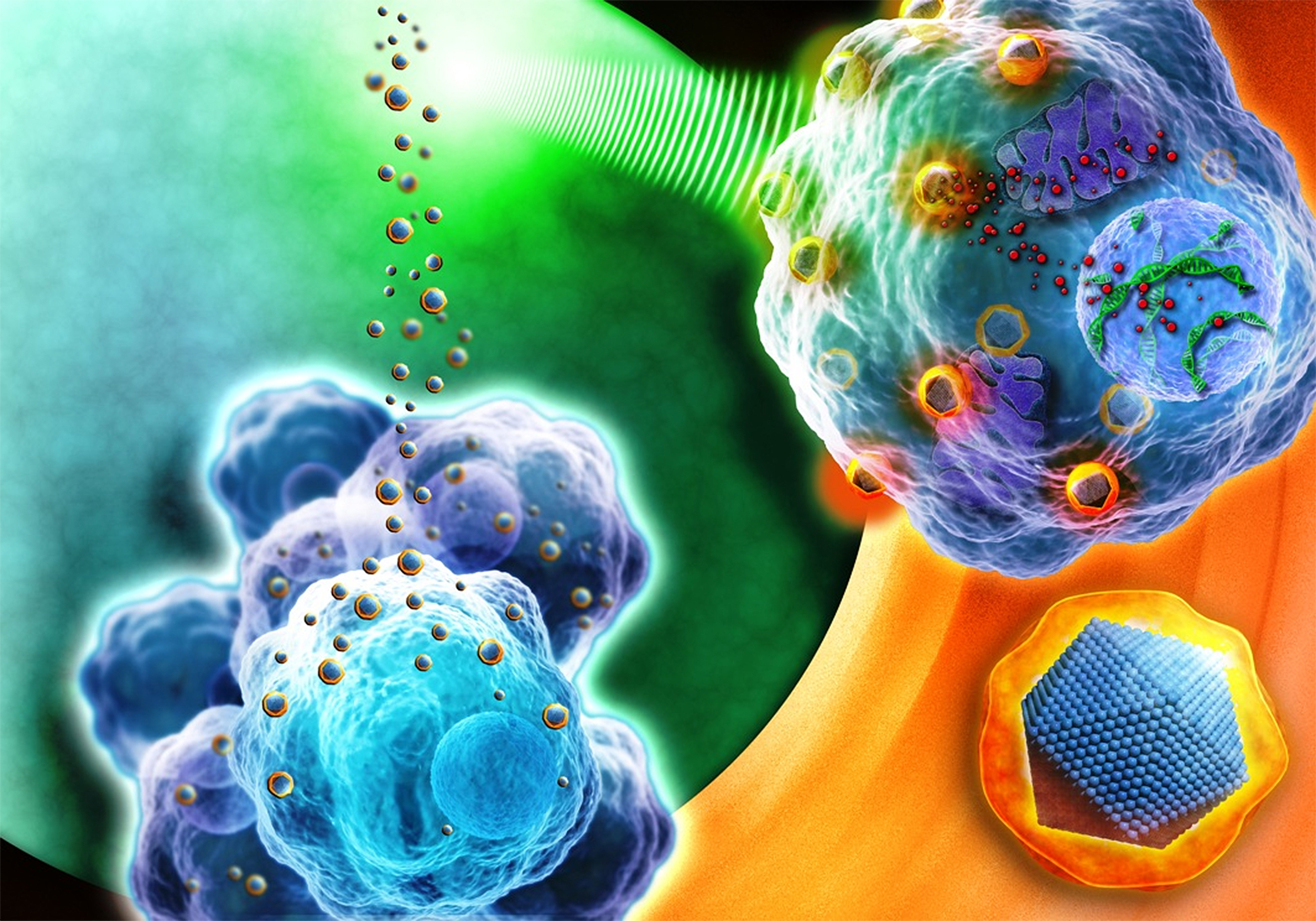
Los científicos están estudiando cada vez más el uso de nanomedicamentos para el tratamiento contra el cáncer. Dentro de esta tendencia, investigadores de Bélgica y México analizan el comportamiento de fármacos con la inclusión de nanopartículas de óxido de hierro, las cuales permiten atacar directamente tumores, células o tejidos cancerígenos, con el fin de encontrar una alternativa más segura y eficaz a la radio o quimioterapia.
A diferencia de otro tipo de terapias, las nanopartículas de óxido de hierro poseen una magnetización inducible, lo cual les permite ser dirigidas hacia un tejido específico y provocar hipertermia (golpe de calor) para eliminar los tumores. Sin embargo, a pesar de sus potenciales beneficios, también aportan nuevos retos a la seguridad de la salud del paciente, por lo que deben ser analizadas para garantizar su eficacia y evitar sus posibles efectos adversos.
Para no pasar por alto los efectos secundarios que conlleva para la salud el uso de nanopartículas de óxido de hierro, se han realizado estudios en células in vitro y en modelos animales por parte del grupo de investigadores, conformado por Vicente Escamilla Rivera y Omar Lozano, ambos doctores del Centro de Investigación y de Estudios Avanzados (Cinvestav) del Instituto Politécnico Nacional (México), y el profesor Stéphane Lucas, del Laboratorio de Análisis por Reacciones Nucleares (LARN) de la Universidad de Namur (Bélgica).
Se pretende que a través del uso de nanopartículas de óxido de hierro los fármacos resulten más eficientes, sean encapsulados y se evite que el metabolismo del organismo las desvíe, para que ataquen directamente a las células enfermas y no existan efectos secundarios.
Las nanopartículas magnéticas tienen ventajas: se inyectan a la sangre y por medio de un campo magnético externo, semejante al de un imán, son llevadas hasta el tumor, donde el material vibra y eleva la temperatura del tejido hasta destruir el tejido no deseado, explica Escamilla Rivera en la información recogida por AlphaGalileo.
Experimentos
En los experimentos fueron comparados diferentes tipos de partículas y se las expuso a proteínas y células en un escenario real simulado (in vitro y modelos animales) con el fin de evaluar los efectos adversos y detectar qué tipo de recubrimiento es más biocompatible con el organismo.
La dificultad de trabajar con nanopartículas de óxido de hierro es que al inyectarlo al organismo, el sistema inmunológico lo reconoce como amenaza y modifica su eficacia; inhabilita el medicamento o causa estrés oxidativo.
Por ello la investigación trabajó con tres tipos de nanopartículas: desnudas; recubiertas con el polímero polietilenglicol (PEG); y recubiertas con polivinilpirrolidona (PVP), con el objetivo de descubrir cuál de ellas pasa inadvertida por el cuerpo y ataca directa al blanco, detalla el especialista en nanotoxicología.
A diferencia de otro tipo de terapias, las nanopartículas de óxido de hierro poseen una magnetización inducible, lo cual les permite ser dirigidas hacia un tejido específico y provocar hipertermia (golpe de calor) para eliminar los tumores. Sin embargo, a pesar de sus potenciales beneficios, también aportan nuevos retos a la seguridad de la salud del paciente, por lo que deben ser analizadas para garantizar su eficacia y evitar sus posibles efectos adversos.
Para no pasar por alto los efectos secundarios que conlleva para la salud el uso de nanopartículas de óxido de hierro, se han realizado estudios en células in vitro y en modelos animales por parte del grupo de investigadores, conformado por Vicente Escamilla Rivera y Omar Lozano, ambos doctores del Centro de Investigación y de Estudios Avanzados (Cinvestav) del Instituto Politécnico Nacional (México), y el profesor Stéphane Lucas, del Laboratorio de Análisis por Reacciones Nucleares (LARN) de la Universidad de Namur (Bélgica).
Se pretende que a través del uso de nanopartículas de óxido de hierro los fármacos resulten más eficientes, sean encapsulados y se evite que el metabolismo del organismo las desvíe, para que ataquen directamente a las células enfermas y no existan efectos secundarios.
Las nanopartículas magnéticas tienen ventajas: se inyectan a la sangre y por medio de un campo magnético externo, semejante al de un imán, son llevadas hasta el tumor, donde el material vibra y eleva la temperatura del tejido hasta destruir el tejido no deseado, explica Escamilla Rivera en la información recogida por AlphaGalileo.
Experimentos
En los experimentos fueron comparados diferentes tipos de partículas y se las expuso a proteínas y células en un escenario real simulado (in vitro y modelos animales) con el fin de evaluar los efectos adversos y detectar qué tipo de recubrimiento es más biocompatible con el organismo.
La dificultad de trabajar con nanopartículas de óxido de hierro es que al inyectarlo al organismo, el sistema inmunológico lo reconoce como amenaza y modifica su eficacia; inhabilita el medicamento o causa estrés oxidativo.
Por ello la investigación trabajó con tres tipos de nanopartículas: desnudas; recubiertas con el polímero polietilenglicol (PEG); y recubiertas con polivinilpirrolidona (PVP), con el objetivo de descubrir cuál de ellas pasa inadvertida por el cuerpo y ataca directa al blanco, detalla el especialista en nanotoxicología.
Reacciones adversas
“Uno de los efectos adversos de las nanoparticulas de óxido de hierro es el estrés oxidativo, un desequilibrio entre radicales libres del organismo que afecta a biomoléculas como lípidos o carbohidratos. Otro es la inflamación local o sistémica, asociada a otros padecimientos que forman trombosis, o causan choques anafilácticos”, explica Escamilla, que realiza su doctorado en toxicología en el LARN.
En los modelos de roedores expuestos a las nanopartículas recubiertas con PEG se presentó un aumento en la concentración de moléculas llamadas anafilotoxinas, que pueden causar un choque anafiláctico cuando se producen en grandes cantidades, además del aumento de citocinas pro-inflamatorias tanto a nivel local como sistémico. Por ahora las pruebas se han hecho en modelos animales o in vitro; sin embargo, hasta que se garantice la salud del paciente no se podrá empezar a comercializar, concluye el egresado del Cinvestav.
Hace dos años, un equipo de científicos de la Universidad de Georgia, en Estados Unidos, utilizó también nanopartículas de óxido de hierro y campos magnéticos alternantes para atacar las células cancerígenas de tumores de cuello y cabeza de ratones. Los resultados mostraron que este sistema puede matar las células cancerígenas en tan sólo media hora, sin que resulten dañadas las células sanas cercanas.
“Uno de los efectos adversos de las nanoparticulas de óxido de hierro es el estrés oxidativo, un desequilibrio entre radicales libres del organismo que afecta a biomoléculas como lípidos o carbohidratos. Otro es la inflamación local o sistémica, asociada a otros padecimientos que forman trombosis, o causan choques anafilácticos”, explica Escamilla, que realiza su doctorado en toxicología en el LARN.
En los modelos de roedores expuestos a las nanopartículas recubiertas con PEG se presentó un aumento en la concentración de moléculas llamadas anafilotoxinas, que pueden causar un choque anafiláctico cuando se producen en grandes cantidades, además del aumento de citocinas pro-inflamatorias tanto a nivel local como sistémico. Por ahora las pruebas se han hecho en modelos animales o in vitro; sin embargo, hasta que se garantice la salud del paciente no se podrá empezar a comercializar, concluye el egresado del Cinvestav.
Hace dos años, un equipo de científicos de la Universidad de Georgia, en Estados Unidos, utilizó también nanopartículas de óxido de hierro y campos magnéticos alternantes para atacar las células cancerígenas de tumores de cuello y cabeza de ratones. Los resultados mostraron que este sistema puede matar las células cancerígenas en tan sólo media hora, sin que resulten dañadas las células sanas cercanas.

 Tendencias Científicas
Tendencias Científicas

 El corazón débil también daña al cerebro
El corazón débil también daña al cerebro CIENCIA ON LINE
CIENCIA ON LINE