
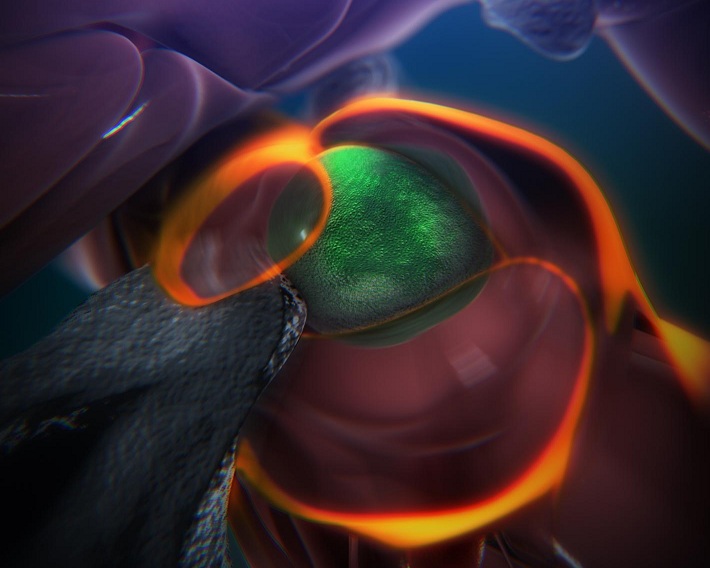
Célula madre sanguínea arraigando en un nicho para producir sangre. Fuente: Hospital Infantil de Boston/Eurekalert!
Se calcula que un humano adulto tiene en su cuerpo 4,5 y 6 litros de sangre, lo que representa el 7% de su peso. Esta sangre es fabricada mediante un proceso denominado hematopoyesis, que se desarrolla fundamentalmente en la médula ósea. En él se forman los llamados “elementos formes” -o sólidos- de la sangre (el resto lo compone el plasma sanguíneo): los eritrocitos, los leucocitos y las plaquetas.
Las responsables de la fabricación de esa sangre son, además, un tipo de células madre, conocidas como células madre hematopoyéticas multipotentes. Científicos del Hospital Infantil de Boston (EEUU) han conseguido ahora, por vez primera, visualizar a dichas células en plena acción.
Los investigadores usaron un pez cebra transparente; un truco genético con el que se marcó a las células madre sanguíneas de verde; y una técnica avanzada de imagen (microscopía electrónica y confocal) para obtener esta primera visión directa de cómo dichas células se arraigan en el cuerpo para generar sangre. Las imágenes obtenidas han revelado un proceso sorprendentemente dinámico, informa el Hospital de Boston en un comunicado difundido por Eurekalert!
Un abrazo maternal
Ya se sabía que, durante el desarrollo, las células madre sanguíneas surgen en la aorta, el vaso sanguíneo más importante en el embrión. A continuación, estas células circulan por el cuerpo hasta que encuentran un "nicho" en el que se preparan para generar sangre.
Las imágenes obtenidas muestran cómo, al alcanzar esos nichos (en el pez cebra están en la cola), las células madre sanguíneas de peces recién nacidos se adhieren a las paredes de los vasos sanguíneos. Allí, una serie de señales químicas incitan a las células a apretarse contra la pared de los vasos para situarse en un espacio situado justo fuera de estos.
En dicho espacio, una gran cantidad de células comienzan a envolver a las células madre sanguíneas, como el cuerpo de una madre al feto. Cuando las células madre están así “abrazadas”, dentro del estroma o matriz celular formado, se agarran a él con estructuras similares a ganchos.
Por último, con el tiempo, las células madre sanguíneas comienzan a dividirse. Las “hijas” dejan entonces el nicho mientras la madre se queda. Pero, al final, todas las células madre salen para colonizar el sitio en que, en adelante, producirán más sangre (en el pez cebra es el riñón).
Las responsables de la fabricación de esa sangre son, además, un tipo de células madre, conocidas como células madre hematopoyéticas multipotentes. Científicos del Hospital Infantil de Boston (EEUU) han conseguido ahora, por vez primera, visualizar a dichas células en plena acción.
Los investigadores usaron un pez cebra transparente; un truco genético con el que se marcó a las células madre sanguíneas de verde; y una técnica avanzada de imagen (microscopía electrónica y confocal) para obtener esta primera visión directa de cómo dichas células se arraigan en el cuerpo para generar sangre. Las imágenes obtenidas han revelado un proceso sorprendentemente dinámico, informa el Hospital de Boston en un comunicado difundido por Eurekalert!
Un abrazo maternal
Ya se sabía que, durante el desarrollo, las células madre sanguíneas surgen en la aorta, el vaso sanguíneo más importante en el embrión. A continuación, estas células circulan por el cuerpo hasta que encuentran un "nicho" en el que se preparan para generar sangre.
Las imágenes obtenidas muestran cómo, al alcanzar esos nichos (en el pez cebra están en la cola), las células madre sanguíneas de peces recién nacidos se adhieren a las paredes de los vasos sanguíneos. Allí, una serie de señales químicas incitan a las células a apretarse contra la pared de los vasos para situarse en un espacio situado justo fuera de estos.
En dicho espacio, una gran cantidad de células comienzan a envolver a las células madre sanguíneas, como el cuerpo de una madre al feto. Cuando las células madre están así “abrazadas”, dentro del estroma o matriz celular formado, se agarran a él con estructuras similares a ganchos.
Por último, con el tiempo, las células madre sanguíneas comienzan a dividirse. Las “hijas” dejan entonces el nicho mientras la madre se queda. Pero, al final, todas las células madre salen para colonizar el sitio en que, en adelante, producirán más sangre (en el pez cebra es el riñón).
Aplicaciones médicas
El procedimiento de registro de imágenes se aplicó también en ratones, lo que ha permitido encontrar evidencias de que las células madre de la sangre de los mamíferos pasan por un proceso muy parecido. Esto hace probable que en los seres humanos suceda del mismo modo.
De ser así, esta primera visión directa de la fabricación de la sangre a nivel celular podría proporcionar una serie de pasos para orientar (artificialmente) la generación de sangre, afirman los investigadores. En teoría, “ahora podemos buscar fármacos que afecten a cada paso de este proceso”.
Por tanto, el avance ofrece varias pistas sobre cómo mejorar los trasplantes de médula ósea en pacientes con cáncer, así como sobre cómo tratar las inmunodeficiencias graves o los trastornos sanguíneos.
Más conocimiento sobre la generación de la sangre
Desde el punto de vista médico, también han sido importantes otros descubrimientos recientes sobre la sangre, en este caso porque podrían impulsar el desarrollo de productos celulares sanguíneos para terapias de reemplazo celular.
A mediados de 2014, investigadores de la Universidad de Wisconsin-Madison lograron determinar cómo la naturaleza genera productos precursores de la sangre en las primeras etapas de desarrollo.
En concreto, descubrieron dos programas genéticos que hacían posible la reprogramación de células madre indiferenciadas (susceptibles de convertirse en cualquier tipo de célula) para transformarlas en células madre hematopoyéticas.
En 2013, además, un equipo de científicos de la Escuela Icahn de Medicina de Nueva York consiguió producir células muy parecidas a las células madre hematopoyéticas, a través de la transferencia de cuatro genes al interior de fibroblastos de ratón.
El procedimiento de registro de imágenes se aplicó también en ratones, lo que ha permitido encontrar evidencias de que las células madre de la sangre de los mamíferos pasan por un proceso muy parecido. Esto hace probable que en los seres humanos suceda del mismo modo.
De ser así, esta primera visión directa de la fabricación de la sangre a nivel celular podría proporcionar una serie de pasos para orientar (artificialmente) la generación de sangre, afirman los investigadores. En teoría, “ahora podemos buscar fármacos que afecten a cada paso de este proceso”.
Por tanto, el avance ofrece varias pistas sobre cómo mejorar los trasplantes de médula ósea en pacientes con cáncer, así como sobre cómo tratar las inmunodeficiencias graves o los trastornos sanguíneos.
Más conocimiento sobre la generación de la sangre
Desde el punto de vista médico, también han sido importantes otros descubrimientos recientes sobre la sangre, en este caso porque podrían impulsar el desarrollo de productos celulares sanguíneos para terapias de reemplazo celular.
A mediados de 2014, investigadores de la Universidad de Wisconsin-Madison lograron determinar cómo la naturaleza genera productos precursores de la sangre en las primeras etapas de desarrollo.
En concreto, descubrieron dos programas genéticos que hacían posible la reprogramación de células madre indiferenciadas (susceptibles de convertirse en cualquier tipo de célula) para transformarlas en células madre hematopoyéticas.
En 2013, además, un equipo de científicos de la Escuela Icahn de Medicina de Nueva York consiguió producir células muy parecidas a las células madre hematopoyéticas, a través de la transferencia de cuatro genes al interior de fibroblastos de ratón.
Referencia bibliográfica:
Leonard I. Zon et al. Hematopoietic Stem Cell Arrival Triggers Dynamic Remodeling of the Perivascular Niche. Cell (2015). DOI: 10.1016/j.cell.2014.12.032.
Leonard I. Zon et al. Hematopoietic Stem Cell Arrival Triggers Dynamic Remodeling of the Perivascular Niche. Cell (2015). DOI: 10.1016/j.cell.2014.12.032.

 Tendencias Científicas
Tendencias Científicas

 Los electrones abren un nuevo mundo a la física cuántica
Los electrones abren un nuevo mundo a la física cuántica CIENCIA ON LINE
CIENCIA ON LINE