
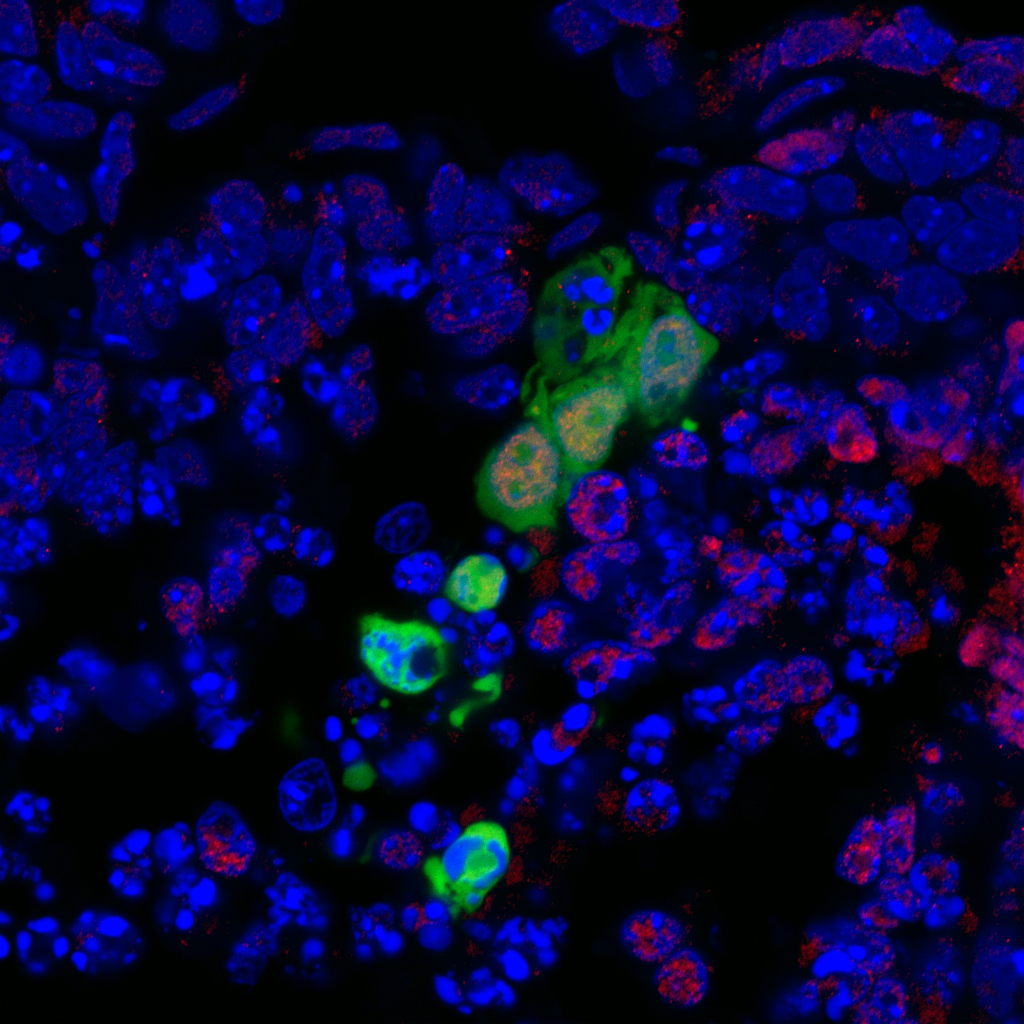
En verde, nuevo tipo de célula madre humana integrándose y desarrollándose en el entorno celular de un embrión de ratón no viable. En rojo, células del linaje del endodermo que pueden dar lugar al tejido que cubre los órganos de los aparatos digestivo y respiratorio. Fuente: Instituto Salk.
La fabricación de órganos de sustitución es un objetivo en el que trabajan diversos grupos de investigación del planeta. Su finalidad es conseguir, algún día, que cualquiera que necesite uno de estos órganos pueda tenerlo, sin necesidad de esperar a que un donante se lo ceda.
Sin embargo, como es obvio, alcanzar este objetivo no es tarea sencilla. Para lograrlo, los científicos trabajan con los constructores más básicos de nuestros órganos: las células madre, que son unas células embrionarias que, por diferenciación a lo largo del desarrollo fetal, van generando los diversos tejidos del organismo.
Hasta la fecha, en los estudios científicos, estas células se han usado teniendo en cuenta el momento en que se encontraban, dentro del desarrollo embrionario. Es decir, que los investigadores las usaban considerando el factor temporal.
Ahora, un equipo de científicos del Salk Institute de La Jolla (California, EEUU), en colaboración, entre otros, con investigadores del Hospital Clínic de Barcelona, la Universidad Católica de Murcia y la Clínica CEMTRO de Madrid, han cambiado este enfoque basado en el tiempo; pues han hallado un tipo de células madre caracterizadas por su ubicación en el embrión (específicas de una zona concreta de este) que son capaces de convertirse en cualquier tipo de tejido y que proliferan en laboratorio mejor que las otras.
Células que se orientan
Bautizadas como “células madre pluripotentes de región selectiva” (rsPSCs, por sus siglas en inglés), las células halladas presentan unas características que hacen posible su producción a gran escala e incluso su alteración genética (editando su ADN celular). Ambas posibilidades son cruciales para las terapias de sustitución celular.
La facilidad con que las rsPSCs proliferan fue comprobada tras aplicarles un cóctel de señales químicas. Estas señales consiguieron que estas células, ubicadas en una placa de laboratorio, se orientaran en el espacio y, en concreto, se identificaran como parte de la región posterior de un embrión de ratón.
A continuación, los científicos insertaron las rsPSCs en regiones parcialmente diseccionadas de embriones de ratón y las tuvieron en cultivo durante 36 horas. Para poder comparar esta nueva metodología con las ya existentes, también insertaron en dichos embriones, por separado, células madre humanas cultivadas con métodos convencionales.
El resultado fue que, mientras estas últimas no se integraron en el embrión, las rsPSCs humanas sí lo hicieron. Además, una vez colocadas en el embrión, iniciaron los procesos de diferenciación que las convertirían en células de los tejidos de las tres capas germinales de un embrión natural: endodermo, mesodermo y ectodermo.
Sin embargo, como es obvio, alcanzar este objetivo no es tarea sencilla. Para lograrlo, los científicos trabajan con los constructores más básicos de nuestros órganos: las células madre, que son unas células embrionarias que, por diferenciación a lo largo del desarrollo fetal, van generando los diversos tejidos del organismo.
Hasta la fecha, en los estudios científicos, estas células se han usado teniendo en cuenta el momento en que se encontraban, dentro del desarrollo embrionario. Es decir, que los investigadores las usaban considerando el factor temporal.
Ahora, un equipo de científicos del Salk Institute de La Jolla (California, EEUU), en colaboración, entre otros, con investigadores del Hospital Clínic de Barcelona, la Universidad Católica de Murcia y la Clínica CEMTRO de Madrid, han cambiado este enfoque basado en el tiempo; pues han hallado un tipo de células madre caracterizadas por su ubicación en el embrión (específicas de una zona concreta de este) que son capaces de convertirse en cualquier tipo de tejido y que proliferan en laboratorio mejor que las otras.
Células que se orientan
Bautizadas como “células madre pluripotentes de región selectiva” (rsPSCs, por sus siglas en inglés), las células halladas presentan unas características que hacen posible su producción a gran escala e incluso su alteración genética (editando su ADN celular). Ambas posibilidades son cruciales para las terapias de sustitución celular.
La facilidad con que las rsPSCs proliferan fue comprobada tras aplicarles un cóctel de señales químicas. Estas señales consiguieron que estas células, ubicadas en una placa de laboratorio, se orientaran en el espacio y, en concreto, se identificaran como parte de la región posterior de un embrión de ratón.
A continuación, los científicos insertaron las rsPSCs en regiones parcialmente diseccionadas de embriones de ratón y las tuvieron en cultivo durante 36 horas. Para poder comparar esta nueva metodología con las ya existentes, también insertaron en dichos embriones, por separado, células madre humanas cultivadas con métodos convencionales.
El resultado fue que, mientras estas últimas no se integraron en el embrión, las rsPSCs humanas sí lo hicieron. Además, una vez colocadas en el embrión, iniciaron los procesos de diferenciación que las convertirían en células de los tejidos de las tres capas germinales de un embrión natural: endodermo, mesodermo y ectodermo.
Desarrollar órganos dentro de animales
Según explica Juan Carlos Izpisua Belmonte, investigador del Instituto Salk y director del estudio en un comunicado de dicho centro, “las células específicas de zona que hemos descubierto podrían proporcionar ventajas tremendas para el estudio en laboratorio del desarrollo, la evolución y las enfermedades; y además abren vías para la generación de nuevas terapias”.
Pero los resultados no solo proporcionan una nueva forma de analizar el desarrollo humano temprano, sino que además ofrecen una nueva esperanza para el cultivo de tejidos y órganos humanos en un animal huésped.
Los investigadores concluyen que, por tanto, “no solo necesitamos considerar el tiempo, sino también las características espaciales de las células madre. Comprender ambos aspectos de la identidad de estas células puede resultar crucial para generar tipos de células maduras y funcionales para la medicina regenerativa ”.
Minirriñones de laboratorio y otros avances
En 2013, Izpisúa Belmonte y sus colaboradores alcanzaron otro hito científico al conseguir crear estructuras renales tridimensionales en cultivo utilizando células madre humanas, algo que hasta entonces jamás se había logrado.
Para crear estas estructuras renales tridimensionales, los investigadores utilizaron células madre embrionarias y células madre pluripotentes inducidas (iPS) , obtenidas a partir de células humanas de la piel.
Aplicando un protocolo desarrollado por Izpisúa y su equipo, se consiguió convertir dichas células en células progenitoras del sistema de filtración y colección renal, en tan solo cuatro días en cultivo. Una vez logrado esto, las células fueron puestas en cultivo conjuntamente con células de blastema metanéfrico de ratón (una estructura del riñón embrionario).
El resultado fue que los dos tipos de células se ensamblaron formando estructuras tridimensionales similares al riñón embrionario, con un sistema colector exclusivamente formado por células humanas. Con el tiempo, estas células progenitoras humanas recapitularon, en cultivo, los procesos de desarrollo del riñón humano.
Se espera que este otro avance facilite la investigación de enfermedades renales, el descubrimiento de nuevos fármacos y sea un paso más hacia la aplicación de terapias basadas en el uso de células madre.
Otros avances recientes hacia el desarrollo artificial de órganos han sido la primera impresión en 3D de un sistema circulatorio (imprescindible para el crecimiento de grandes tejidos complejos) o un innovador método de ingeniería de tejidos que ha demostrado ser útil para crear cantidades grandes de hueso humano maduro para trasplantes y en órganos vitales, como el hígado y el páncreas.
Según explica Juan Carlos Izpisua Belmonte, investigador del Instituto Salk y director del estudio en un comunicado de dicho centro, “las células específicas de zona que hemos descubierto podrían proporcionar ventajas tremendas para el estudio en laboratorio del desarrollo, la evolución y las enfermedades; y además abren vías para la generación de nuevas terapias”.
Pero los resultados no solo proporcionan una nueva forma de analizar el desarrollo humano temprano, sino que además ofrecen una nueva esperanza para el cultivo de tejidos y órganos humanos en un animal huésped.
Los investigadores concluyen que, por tanto, “no solo necesitamos considerar el tiempo, sino también las características espaciales de las células madre. Comprender ambos aspectos de la identidad de estas células puede resultar crucial para generar tipos de células maduras y funcionales para la medicina regenerativa ”.
Minirriñones de laboratorio y otros avances
En 2013, Izpisúa Belmonte y sus colaboradores alcanzaron otro hito científico al conseguir crear estructuras renales tridimensionales en cultivo utilizando células madre humanas, algo que hasta entonces jamás se había logrado.
Para crear estas estructuras renales tridimensionales, los investigadores utilizaron células madre embrionarias y células madre pluripotentes inducidas (iPS) , obtenidas a partir de células humanas de la piel.
Aplicando un protocolo desarrollado por Izpisúa y su equipo, se consiguió convertir dichas células en células progenitoras del sistema de filtración y colección renal, en tan solo cuatro días en cultivo. Una vez logrado esto, las células fueron puestas en cultivo conjuntamente con células de blastema metanéfrico de ratón (una estructura del riñón embrionario).
El resultado fue que los dos tipos de células se ensamblaron formando estructuras tridimensionales similares al riñón embrionario, con un sistema colector exclusivamente formado por células humanas. Con el tiempo, estas células progenitoras humanas recapitularon, en cultivo, los procesos de desarrollo del riñón humano.
Se espera que este otro avance facilite la investigación de enfermedades renales, el descubrimiento de nuevos fármacos y sea un paso más hacia la aplicación de terapias basadas en el uso de células madre.
Otros avances recientes hacia el desarrollo artificial de órganos han sido la primera impresión en 3D de un sistema circulatorio (imprescindible para el crecimiento de grandes tejidos complejos) o un innovador método de ingeniería de tejidos que ha demostrado ser útil para crear cantidades grandes de hueso humano maduro para trasplantes y en órganos vitales, como el hígado y el páncreas.
Referencia bibliográfica:
Jun Wu, Daiji Okamura, Mo Li, Keiichiro Suzuki, Chongyuan Luo, Li Ma, Yupeng He, Zhongwei Li, Chris Benner, Isao Tamura, Marie N. Krause, Joseph R. Nery, Tingting Du, Zhuzhu Zhang, Tomoaki Hishida, Yuta Takahashi, Emi Aizawa, Na Young Kim, Jeronimo Lajara, Pedro Guillen, Josep M. Campistol, Concepcion Rodriguez Esteban, Pablo J. Ross, Alan Saghatelian, Bing Ren, Joseph R. Ecker, Juan Carlos Izpisua Belmonte. An alternative pluripotent state confers interspecies chimaeric competency. Nature (2015). DOI: 10.1038/nature14413.

 Tendencias Científicas
Tendencias Científicas

 Los electrones abren un nuevo mundo a la física cuántica
Los electrones abren un nuevo mundo a la física cuántica CIENCIA ON LINE
CIENCIA ON LINE