Un reciente estudio multidisciplinar, coordinado por investigadores de la Universidad de Bar-Ilan de Israel y publicado por la revista PLOS Pathogens ha dado un salto de gigante en el conocimiento y posible control de las infecciones por herpes virus.
En este trabajo, se ha realizado una batería de experimentos que ha conducido a establecer un nuevo sistema de modelado de los estadíos latentes del varicella zoster virus (VZV) sin agredir el cuerpo humano y evitar también el uso de animales de experimentación.
Estudiar por qué este virus se mantenía latente o por qué en un momento determinado se reactivaba, era todo un misterio sin resolver, debido a que no se había logrado reproducir un estado duradero in vivo o in vitro del virus que permitiese reactivarlo experimentalmente. Sin embargo, este problema parece que se ha minimizado, ya que este equipo ha logrado obtener un modelo de mantenimiento del virus latente. Es decir, ha conseguido mantener escondidos los virus durante largos períodos de tiempo y, posteriormente, reactivarlos para iniciar la infección vírica, con su extensión a otras células.
Este mantenimiento se ha realizado en neuronas humanas obtenidas a partir de células madre embrionarias. Esto permitirá realizar estudios sobre la aplicación de diversos estímulos y comprobar si existe o no reactivación de un virus que ha permanecido latente experimentalmente durante un largo período de tiempo. Metafóricamente, es como si pudiésemos estudiar que ocurre en el cerebro humano, pero, sin dañar al propio ser humano. Pero, ¿por qué esto es tan enormemente interesante?, ¿qué permitirá este hallazgo?
Herpes zoster el inquilino menos querido
Todo comienza en la infancia, cuando padecemos varicela, considerada como una enfermedad leve y aparentemente común que tras ser debidamente tratada, en principio, apenas nos dejará secuelas. Pero, a pesar de ser tratada, ¿realmente ha desaparecido el virus de nuestro cuerpo? Y si no es así, ¿dónde se encuentra?
Puede ser que este virus permanezca latente sin que sepamos que está conviviendo con nosotros y tras varios años, cuando, probablemente, ni recordaremos si hemos padecido varicela, un buen día reaparece como herpes zoster, provocando una enfermedad reconocida como una importante causa de morbilidad, sobre todo, en personas de avanzada edad.
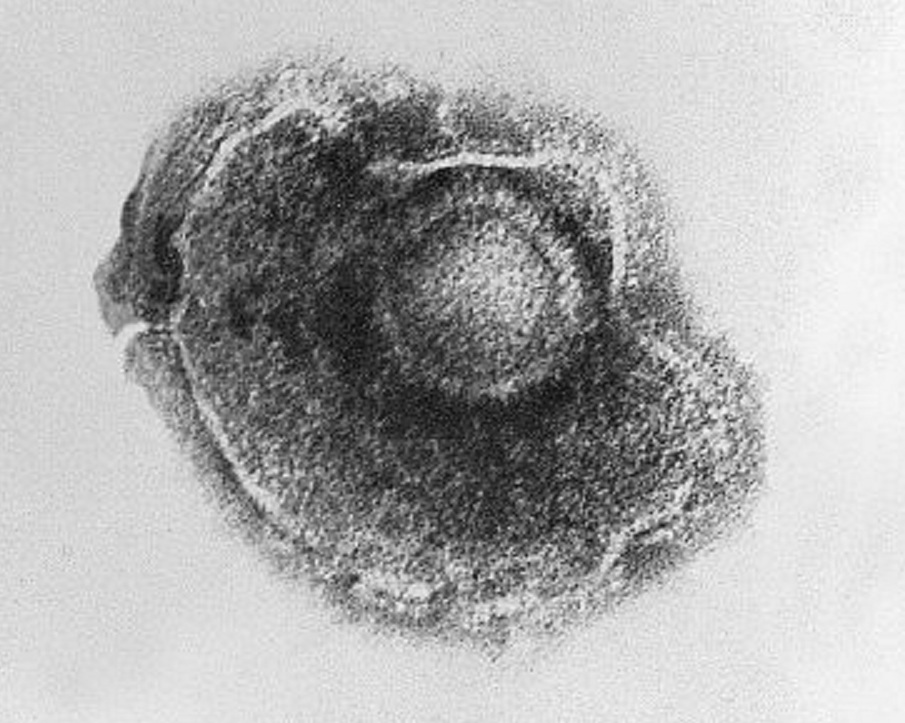
La varicela está causada por un virus perteneciente a la familia Herpesviridae. Un virus que, inicialmente, se manifiesta como un microorganismo patógeno fácil de controlar y sin muchas complicaciones. Estas partículas víricas se desplazan a lo largo de los axones neuronales para llegar a los ganglios sensitivos, lugar donde permanecen latentes, incluso durante años.
Este estado de latencia es mantenido gracias a nuestro sistema inmune celular que impide la reactivación vírica. A lo largo de los años, la propia situación latente (entre otros factores), hace que el cuerpo esté en continuo contacto con el virus. A veces pueden darse pequeñas fugas del virus, lo que hace que el sistema inmune se mantenga en constante alerta frente a este microorganismo.
Ahora bien, este estado de dormición del virus está generando graves problemas médicos, por ejemplo a la hora de realizarse transplantes. En este sentido, Kamber y sus colaboradores han publicado en abril de este año un interesante trabajo sobre los efectos de estos virus en pacientes con mieloma transplantados y los problemas que éstos patógenos producen.
Los problemas en los procesos de transplante o en aquellas personas con un sistema inmune debilitado provienen del hecho de que las defensas caen, entonces el virus sale de su estado de letargo y comienza a replicarse provocando las lesiones típicas de herpes zoster. En esta situación el virus puede llegar a convertirse en un importante enemigo muy difícil de combatir y a medida que envejecemos el riesgo de padecerlo se incrementa debido a que nuestro sistema inmune se va debilitando y deteriorando.
En este trabajo, se ha realizado una batería de experimentos que ha conducido a establecer un nuevo sistema de modelado de los estadíos latentes del varicella zoster virus (VZV) sin agredir el cuerpo humano y evitar también el uso de animales de experimentación.
Estudiar por qué este virus se mantenía latente o por qué en un momento determinado se reactivaba, era todo un misterio sin resolver, debido a que no se había logrado reproducir un estado duradero in vivo o in vitro del virus que permitiese reactivarlo experimentalmente. Sin embargo, este problema parece que se ha minimizado, ya que este equipo ha logrado obtener un modelo de mantenimiento del virus latente. Es decir, ha conseguido mantener escondidos los virus durante largos períodos de tiempo y, posteriormente, reactivarlos para iniciar la infección vírica, con su extensión a otras células.
Este mantenimiento se ha realizado en neuronas humanas obtenidas a partir de células madre embrionarias. Esto permitirá realizar estudios sobre la aplicación de diversos estímulos y comprobar si existe o no reactivación de un virus que ha permanecido latente experimentalmente durante un largo período de tiempo. Metafóricamente, es como si pudiésemos estudiar que ocurre en el cerebro humano, pero, sin dañar al propio ser humano. Pero, ¿por qué esto es tan enormemente interesante?, ¿qué permitirá este hallazgo?
Herpes zoster el inquilino menos querido
Todo comienza en la infancia, cuando padecemos varicela, considerada como una enfermedad leve y aparentemente común que tras ser debidamente tratada, en principio, apenas nos dejará secuelas. Pero, a pesar de ser tratada, ¿realmente ha desaparecido el virus de nuestro cuerpo? Y si no es así, ¿dónde se encuentra?
Puede ser que este virus permanezca latente sin que sepamos que está conviviendo con nosotros y tras varios años, cuando, probablemente, ni recordaremos si hemos padecido varicela, un buen día reaparece como herpes zoster, provocando una enfermedad reconocida como una importante causa de morbilidad, sobre todo, en personas de avanzada edad.
La varicela está causada por un virus perteneciente a la familia Herpesviridae. Un virus que, inicialmente, se manifiesta como un microorganismo patógeno fácil de controlar y sin muchas complicaciones. Estas partículas víricas se desplazan a lo largo de los axones neuronales para llegar a los ganglios sensitivos, lugar donde permanecen latentes, incluso durante años.
Este estado de latencia es mantenido gracias a nuestro sistema inmune celular que impide la reactivación vírica. A lo largo de los años, la propia situación latente (entre otros factores), hace que el cuerpo esté en continuo contacto con el virus. A veces pueden darse pequeñas fugas del virus, lo que hace que el sistema inmune se mantenga en constante alerta frente a este microorganismo.
Ahora bien, este estado de dormición del virus está generando graves problemas médicos, por ejemplo a la hora de realizarse transplantes. En este sentido, Kamber y sus colaboradores han publicado en abril de este año un interesante trabajo sobre los efectos de estos virus en pacientes con mieloma transplantados y los problemas que éstos patógenos producen.
Los problemas en los procesos de transplante o en aquellas personas con un sistema inmune debilitado provienen del hecho de que las defensas caen, entonces el virus sale de su estado de letargo y comienza a replicarse provocando las lesiones típicas de herpes zoster. En esta situación el virus puede llegar a convertirse en un importante enemigo muy difícil de combatir y a medida que envejecemos el riesgo de padecerlo se incrementa debido a que nuestro sistema inmune se va debilitando y deteriorando.
La reaparición
Como hemos comentado, el herpes zoster es el resultado de la reactivación interna del virus causante de la varicela. Pero, ¿cuáles son las causas que provocan esta reactivación? La respuesta a esta pregunta es mucho más complicada de lo que en principio pudiera parecer. Actualmente, y pese a que las investigaciones sobre este virus son notables, todavía no existe suficiente conocimiento como para poder hacerlo.
Previamente, se realizaron estudios sobre ratas, ratones y conejillo de india, pero, en ningún caso quedó demostrada la capacidad de reactivación. Únicamente en el conejillo de indias la reactivación quedó demostrada mediante una sobreexpresión de una proteína reguladora concreta de la transcripción viral (proteína básica para que el virus se “reproduzca”).
El trabajo de investigación de Amus Markus y sus colaboradores, al que hacemos referencia, es un aporte de gran importancia, pues constituye el inicio del proceso de respuesta a esta complicada pregunta y a las dos que nos hacíamos al inicio del artículo, el enorme interés que suscita el modelo obtenido por este equipo. Y es que, el modelo presentado que mantiene a los virus latentes durante semanas y permite reactivarlos por diversos estímulos, genera la posibilidad de mejorar las estrategias de prevención y tratamiento de esta enfermedad.
De hecho, este modelo va a facilitar la comprensión de la biología de la reactivación del VZV, algo imposible hasta la fecha, así como, nuevos avances biomédicos y farmacológicos que minimicen los graves trastornos neurológicos que este tipo de virus produce.
Un futuro prometedor para graves problemas
El herpes zoster, enfermedad común que, habitualmente puede presentar diversas complicaciones, presenta un dolor asociado permanente en la fase aguda y una vez que se han originado las vesículas características del herpes, un gran número de pacientes, manifiesta dolor crónico, difícil de tratar.
Este dolor es conocido como neuralgia post-herpética e implica pérdida de autonomía y una calidad de vida pobre que puede dar lugar a enfermedades progresivas y graves.
Pacientes inmunodeprimidos, aquellos que padecen ciertos cánceres, pacientes infectados con el virus HIV, pacientes que han recibido transplantes de órganos y aquellos que recibieron terapias inmunosupresoras tienden a un mayor riesgo de padecer herpes zoster que individuos inmunocompetentes. Así como, aquellas personas que presentan factores de riesgo a padecer enfermedades vasculares, según ha declarado la Dra. Judith Breuer para la revista Neurology Today.
Por otro lado, en casos excepcionales el herpes, incluso puede extenderse a órganos internos, complicación que también pude resultar extremadamente peligrosa y que afecta especialmente a personas con inmunodeficiencia o con un sistema inmunitario debilitado por el consumo de determinados medicamentos (inmunosupresores).
Abriendo las puertas del cerebro
En definitiva, este virus (como acabamos de ver a través de algunos ejemplos) genera una gran cantidad de problemas médicos. Esto hace que el VZV se convierta en uno de los grandes retos biomédicos actuales y el conocimiento de sus efectos neurológicos sea un elemento esencial.
Pues bien, este modelo permite “observar” indirectamente los fenómenos infectivos en el cerebro, uno de los órganos más complejos y misteriosos del cuerpo humano, por lo que su estudio y comprensión resulta realmente complicado. Si pensamos por un momento en el caso de las infecciones por priones, las denominadas “vacas locas”, seguro que nos viene a la cabeza las imágenes de aquellos cortes histológicos de cerebro vacuno gracias a los cuales se sabía si dicho animal estaba afectado por esas proteínas infectivas.
Este modelo posibilita conocer como el VZV se va “moviendo” por nuestro cerebro, pero además también podría ser reajustado y adaptado para el estudio de otras infecciones virales que afecten al sistema nervioso. Recordemos, para finalizar, que los virus, única y exclusivamente, pueden ser estudiados en cultivo celular.
En definitiva, este trabajo no sólo nos acerca a una mejor comprensión del VZV, sino que también nos permite tener esperanza en la consecución de mejores tratamientos para los herpes virus, así como, ampliar el conocimiento de otros virus que afectan al sistema nervioso humano.
Como hemos comentado, el herpes zoster es el resultado de la reactivación interna del virus causante de la varicela. Pero, ¿cuáles son las causas que provocan esta reactivación? La respuesta a esta pregunta es mucho más complicada de lo que en principio pudiera parecer. Actualmente, y pese a que las investigaciones sobre este virus son notables, todavía no existe suficiente conocimiento como para poder hacerlo.
Previamente, se realizaron estudios sobre ratas, ratones y conejillo de india, pero, en ningún caso quedó demostrada la capacidad de reactivación. Únicamente en el conejillo de indias la reactivación quedó demostrada mediante una sobreexpresión de una proteína reguladora concreta de la transcripción viral (proteína básica para que el virus se “reproduzca”).
El trabajo de investigación de Amus Markus y sus colaboradores, al que hacemos referencia, es un aporte de gran importancia, pues constituye el inicio del proceso de respuesta a esta complicada pregunta y a las dos que nos hacíamos al inicio del artículo, el enorme interés que suscita el modelo obtenido por este equipo. Y es que, el modelo presentado que mantiene a los virus latentes durante semanas y permite reactivarlos por diversos estímulos, genera la posibilidad de mejorar las estrategias de prevención y tratamiento de esta enfermedad.
De hecho, este modelo va a facilitar la comprensión de la biología de la reactivación del VZV, algo imposible hasta la fecha, así como, nuevos avances biomédicos y farmacológicos que minimicen los graves trastornos neurológicos que este tipo de virus produce.
Un futuro prometedor para graves problemas
El herpes zoster, enfermedad común que, habitualmente puede presentar diversas complicaciones, presenta un dolor asociado permanente en la fase aguda y una vez que se han originado las vesículas características del herpes, un gran número de pacientes, manifiesta dolor crónico, difícil de tratar.
Este dolor es conocido como neuralgia post-herpética e implica pérdida de autonomía y una calidad de vida pobre que puede dar lugar a enfermedades progresivas y graves.
Pacientes inmunodeprimidos, aquellos que padecen ciertos cánceres, pacientes infectados con el virus HIV, pacientes que han recibido transplantes de órganos y aquellos que recibieron terapias inmunosupresoras tienden a un mayor riesgo de padecer herpes zoster que individuos inmunocompetentes. Así como, aquellas personas que presentan factores de riesgo a padecer enfermedades vasculares, según ha declarado la Dra. Judith Breuer para la revista Neurology Today.
Por otro lado, en casos excepcionales el herpes, incluso puede extenderse a órganos internos, complicación que también pude resultar extremadamente peligrosa y que afecta especialmente a personas con inmunodeficiencia o con un sistema inmunitario debilitado por el consumo de determinados medicamentos (inmunosupresores).
Abriendo las puertas del cerebro
En definitiva, este virus (como acabamos de ver a través de algunos ejemplos) genera una gran cantidad de problemas médicos. Esto hace que el VZV se convierta en uno de los grandes retos biomédicos actuales y el conocimiento de sus efectos neurológicos sea un elemento esencial.
Pues bien, este modelo permite “observar” indirectamente los fenómenos infectivos en el cerebro, uno de los órganos más complejos y misteriosos del cuerpo humano, por lo que su estudio y comprensión resulta realmente complicado. Si pensamos por un momento en el caso de las infecciones por priones, las denominadas “vacas locas”, seguro que nos viene a la cabeza las imágenes de aquellos cortes histológicos de cerebro vacuno gracias a los cuales se sabía si dicho animal estaba afectado por esas proteínas infectivas.
Este modelo posibilita conocer como el VZV se va “moviendo” por nuestro cerebro, pero además también podría ser reajustado y adaptado para el estudio de otras infecciones virales que afecten al sistema nervioso. Recordemos, para finalizar, que los virus, única y exclusivamente, pueden ser estudiados en cultivo celular.
En definitiva, este trabajo no sólo nos acerca a una mejor comprensión del VZV, sino que también nos permite tener esperanza en la consecución de mejores tratamientos para los herpes virus, así como, ampliar el conocimiento de otros virus que afectan al sistema nervioso humano.
Referencia bibliográfica:
Amos Markus, et al. An In Vitro Model of Latency and Reactivation of Varicella Zoster Virus in Human Stem Cell-Derived Neurons. PLOS Pathogens (2015). DOI: 10.1371/journal.ppat.1004885
Amos Markus, et al. An In Vitro Model of Latency and Reactivation of Varicella Zoster Virus in Human Stem Cell-Derived Neurons. PLOS Pathogens (2015). DOI: 10.1371/journal.ppat.1004885

 Tendencias Científicas
Tendencias Científicas

 El corazón débil también daña al cerebro
El corazón débil también daña al cerebro CIENCIA ON LINE
CIENCIA ON LINE