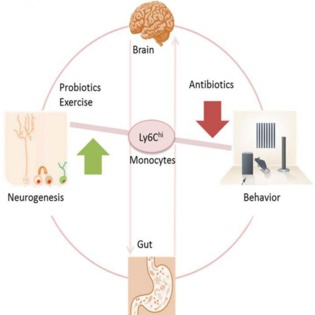
Esquema relacional entre el cerebro, el sistema inmune y el intestino. Imagen: Mohle et al. Fuente: Cell Reports.
Los antibióticos lo suficientemente fuertes como para matar las bacterias del intestino también pueden detener el crecimiento de nuevas células cerebrales en el hipocampo, una sección del cerebro asociada con la memoria, según un estudio en ratones publicado en Cell Reports.
Los investigadores también han descubierto una pista de por qué: un tipo de glóbulo blanco parece actuar como comunicador entre el cerebro, el sistema inmunológico, y el intestino.
"Hemos encontrado que un tratamiento antibiótico prolongado podría afectar a la función cerebral", dice la autora Susanne Asu Wolf, del Centro Max Delbrueck de Medicina Molecular de Berlín (Alemania), en la nota de prensa de Cell Press, recogida por EurekAlert! "Sin embargo, los probióticos y el ejercicio pueden equilibrar la plasticidad cerebral y deben ser considerados como una opción real de tratamiento".
Lobo vio por primera vez indicios de que el sistema inmune podría influir en la salud y el crecimiento de las células del cerebro investigando las células T hace casi 10 años. Sin embargo, había pocos estudios que hubieran encontrado un vínculo que fuera desde el cerebro hasta el sistema inmunológico y de nuevo al intestino.
En el nuevo estudio, los investigadores dieron a un grupo de ratones suficientes antibióticos para que estuvieran casi libres de microbios intestinales. En comparación con los ratones no tratados, los ratones que perdieron sus bacterias intestinales saludables realizaban peor unas pruebas de memoria y mostraban una pérdida de la neurogénesis (nuevas células cerebrales) en una sección de su hipocampo que normalmente produce nuevas células cerebrales durante toda la vida de un individuo.
Al mismo tiempo que los ratones experimentaban pérdida de la memoria y de la neurogénesis, el equipo de investigación detectó un nivel más bajo de los glóbulos blancos (monocitos concretamente) marcados con Ly6Chi, en el cerebro, la sangre y la médula ósea. Así, los investigadores analizaron si eran efectivamente los monocitos Ly6Chi los que estaban detrás de los cambios en la neurogénesis y la memoria.
En otro experimento, el equipo comparó los ratones no tratados con ratones que tenían niveles de bacterias intestinales saludables, pero niveles bajos de Ly6Chi ya fuera debido a la genética o debido al tratamiento con anticuerpos dirigidos a las células Ly6Chi.
Los investigadores también han descubierto una pista de por qué: un tipo de glóbulo blanco parece actuar como comunicador entre el cerebro, el sistema inmunológico, y el intestino.
"Hemos encontrado que un tratamiento antibiótico prolongado podría afectar a la función cerebral", dice la autora Susanne Asu Wolf, del Centro Max Delbrueck de Medicina Molecular de Berlín (Alemania), en la nota de prensa de Cell Press, recogida por EurekAlert! "Sin embargo, los probióticos y el ejercicio pueden equilibrar la plasticidad cerebral y deben ser considerados como una opción real de tratamiento".
Lobo vio por primera vez indicios de que el sistema inmune podría influir en la salud y el crecimiento de las células del cerebro investigando las células T hace casi 10 años. Sin embargo, había pocos estudios que hubieran encontrado un vínculo que fuera desde el cerebro hasta el sistema inmunológico y de nuevo al intestino.
En el nuevo estudio, los investigadores dieron a un grupo de ratones suficientes antibióticos para que estuvieran casi libres de microbios intestinales. En comparación con los ratones no tratados, los ratones que perdieron sus bacterias intestinales saludables realizaban peor unas pruebas de memoria y mostraban una pérdida de la neurogénesis (nuevas células cerebrales) en una sección de su hipocampo que normalmente produce nuevas células cerebrales durante toda la vida de un individuo.
Al mismo tiempo que los ratones experimentaban pérdida de la memoria y de la neurogénesis, el equipo de investigación detectó un nivel más bajo de los glóbulos blancos (monocitos concretamente) marcados con Ly6Chi, en el cerebro, la sangre y la médula ósea. Así, los investigadores analizaron si eran efectivamente los monocitos Ly6Chi los que estaban detrás de los cambios en la neurogénesis y la memoria.
En otro experimento, el equipo comparó los ratones no tratados con ratones que tenían niveles de bacterias intestinales saludables, pero niveles bajos de Ly6Chi ya fuera debido a la genética o debido al tratamiento con anticuerpos dirigidos a las células Ly6Chi.
Resultados
En ambos casos, los ratones con niveles bajos de Ly6Chi mostraron los mismos déficits de memoria y de neurogénesis que los ratones del otro experimento que habían perdido las bacterias intestinales. Además, si los investigadores recuperaban los niveles de Ly6Chi en los ratones tratados con antibióticos, la memoria y la neurogénesis mejoraban.
"Para nosotros fue impresionante encontrar que estas células Ly6Chi viajan desde la periferia hasta el cerebro, y si hay algo mal en el microbioma, Ly6Chi actúa como una célula de comunicación", dice Wolf.
Afortunadamente, los efectos secundarios adversos de los antibióticos podían invertirse. Los ratones que recibieron probióticos o que corrieron sobre una rueda después de recibir antibióticos recuperaban la memoria y la neurogénesis. "La magnitud de la acción de los probióticos en las células Ly6Chi, la neurogénesis y la cognición me impresionó", dice la investigadora.
Trasplante fecal
Pero uno de los resultados del experimento plantea más preguntas acerca de las bacterias de los intestinos y el vínculo entre Ly6Chi y el cerebro. Mientras que los probióticos ayudaron a los ratones a recuperar la memoria, los trasplantes fecales para restaurar las bacterias intestinales saludables no tenían efecto.
"Fue sorprendente que el trasplante fecal normal recuperara en general las bacterias intestinales, pero no la neurogénesis", dice Wolf. "Esto podría ser una pista de los efectos directos de los antibióticos sobre la neurogénesis sin necesidad de utilizar el desvío a través del intestino. Para descifrar esto podríamos tratar a ratones libres de gérmenes sin flora intestinal con antibióticos y ver la diferencia."
En el futuro, los investigadores también esperan ver más ensayos clínicos que investiguen si los tratamientos probióticos mejoran los síntomas en pacientes con trastornos neurodegenerativos y psiquiátricos. "Podríamos medir el resultado en el estado de ánimo, en los síntomas psiquiátricos, la composición del microbioma y en la función inmunológica celular antes y después del tratamiento probiótico", dice Wolf.
En ambos casos, los ratones con niveles bajos de Ly6Chi mostraron los mismos déficits de memoria y de neurogénesis que los ratones del otro experimento que habían perdido las bacterias intestinales. Además, si los investigadores recuperaban los niveles de Ly6Chi en los ratones tratados con antibióticos, la memoria y la neurogénesis mejoraban.
"Para nosotros fue impresionante encontrar que estas células Ly6Chi viajan desde la periferia hasta el cerebro, y si hay algo mal en el microbioma, Ly6Chi actúa como una célula de comunicación", dice Wolf.
Afortunadamente, los efectos secundarios adversos de los antibióticos podían invertirse. Los ratones que recibieron probióticos o que corrieron sobre una rueda después de recibir antibióticos recuperaban la memoria y la neurogénesis. "La magnitud de la acción de los probióticos en las células Ly6Chi, la neurogénesis y la cognición me impresionó", dice la investigadora.
Trasplante fecal
Pero uno de los resultados del experimento plantea más preguntas acerca de las bacterias de los intestinos y el vínculo entre Ly6Chi y el cerebro. Mientras que los probióticos ayudaron a los ratones a recuperar la memoria, los trasplantes fecales para restaurar las bacterias intestinales saludables no tenían efecto.
"Fue sorprendente que el trasplante fecal normal recuperara en general las bacterias intestinales, pero no la neurogénesis", dice Wolf. "Esto podría ser una pista de los efectos directos de los antibióticos sobre la neurogénesis sin necesidad de utilizar el desvío a través del intestino. Para descifrar esto podríamos tratar a ratones libres de gérmenes sin flora intestinal con antibióticos y ver la diferencia."
En el futuro, los investigadores también esperan ver más ensayos clínicos que investiguen si los tratamientos probióticos mejoran los síntomas en pacientes con trastornos neurodegenerativos y psiquiátricos. "Podríamos medir el resultado en el estado de ánimo, en los síntomas psiquiátricos, la composición del microbioma y en la función inmunológica celular antes y después del tratamiento probiótico", dice Wolf.
Referencia bibliográfica:
Möhle, Mattei, y Heimesaat et al.: Ly6Chi Monocytes Provide a Link between Antibiotic-Induced Changes in Gut Microbiota and Adult Hippocampal Neurogenesis. Cell Reports (2016). DOI: 10.1016/j.celrep.2016.04.074.
Möhle, Mattei, y Heimesaat et al.: Ly6Chi Monocytes Provide a Link between Antibiotic-Induced Changes in Gut Microbiota and Adult Hippocampal Neurogenesis. Cell Reports (2016). DOI: 10.1016/j.celrep.2016.04.074.

 Tendencias Científicas
Tendencias Científicas


 El corazón débil también daña al cerebro
El corazón débil también daña al cerebro CIENCIA ON LINE
CIENCIA ON LINE