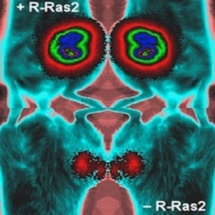
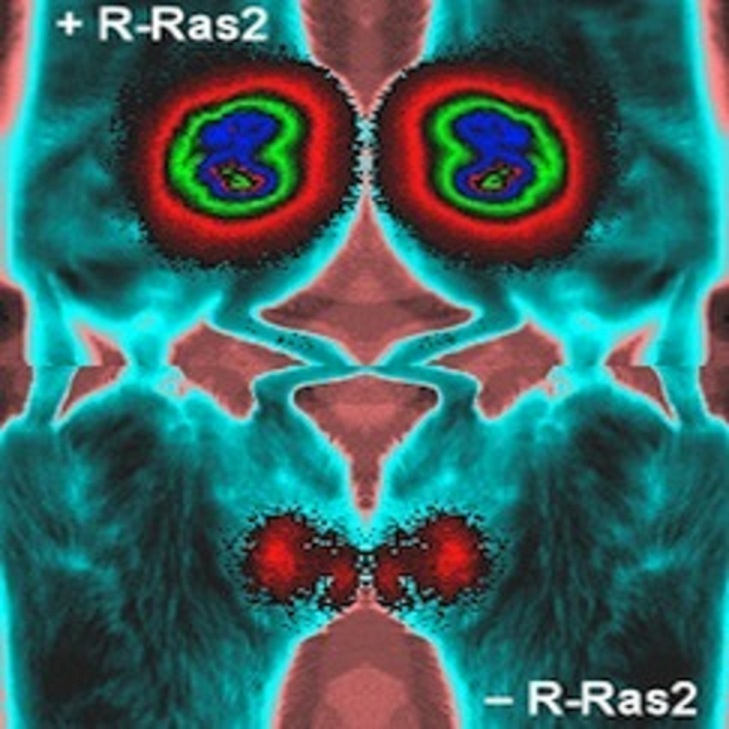
La proteína R-Ras2/TC21 está implicada en dos procesos tumorales, según los científicos. Fuente: CIC.
El cáncer de mama constituye uno de los tumores más frecuentes en las mujeres españolas. Muchas de las muertes que provoca la enfermedad se deben al desarrollo de resistencias a los tratamientos en uso actualmente, la malignidad intrínseca de algunos subtipos de tumor y, sobre todo, al desarrollo de metástasis que dificultan el tratamiento efectivo de las pacientes.
Por tanto, para los expertos es relevante el poder identificar nuevas dianas terapéuticas que permitan abordar estos problemas, bien de manera independiente o combinada con terapias ya existentes.
Ahora, un reciente trabajo del grupo de Xosé R. Bustelo, del Centro de Investigación del Cáncer de Salamanca (CIC-IBMCC), ha permitido identificar una nueva ruta de señalización –el conjunto de respuestas de la célula a determinados estímulos– que interviene tanto en el desarrollo del tumor primario de mama como en la supervivencia de las células cancerosas metastásicas que se han diseminado y establecido en el pulmón.
Según explica la nota de prensa del CIC, recogida por SINC, la eliminación de la proteína R-Ras2/TC21 implicada en dicha ruta bloquea el desarrollo de estos dos procesos malignos.
El trabajo, publicado en Nature Communications, ha contado con la colaboración de los grupos de investigación liderados por Balbino Alarcón, del Centro de Biología Molecular Severo Ochoa de Madrid, y Mercedes Dosil, del Centro de Investigación del Cáncer de Salamanca.
R-Ras2 y cáncer de mama
R-Ras2, también denominada TC21, es una proteína muy parecida a los miembros de la familia Ras. Estos genes suelen mutar y estar implicados en el desarrollo del cáncer. Esto hizo sospechar a los investigadores que debería tener un papel fundamental en el desarrollo de tumores y, por tanto, representar una potencial para el desarrollo de nuevos fármacos.
El nuevo estudio ha confirmado esta idea ya que, utilizando diversos modelos experimentales en ratón, se demostró que la eliminación de la proteína R-Ras2 provocaba un freno en el crecimiento de tumores de mama y, además, un bloqueo en el desarrollo de metástasis en pulmón.
Asimismo, el trabajo muestra también que la eliminación de esta proteína afecta por igual al desarrollo y propiedades metastásicas de dos de los subtipos más frecuentes de tumores de mama, los conocidos por Her2 positivos y los triple negativos. Estos últimos son, actualmente, los más difíciles de tratar en la práctica clínica debido a su alta malignidad.
Por tanto, para los expertos es relevante el poder identificar nuevas dianas terapéuticas que permitan abordar estos problemas, bien de manera independiente o combinada con terapias ya existentes.
Ahora, un reciente trabajo del grupo de Xosé R. Bustelo, del Centro de Investigación del Cáncer de Salamanca (CIC-IBMCC), ha permitido identificar una nueva ruta de señalización –el conjunto de respuestas de la célula a determinados estímulos– que interviene tanto en el desarrollo del tumor primario de mama como en la supervivencia de las células cancerosas metastásicas que se han diseminado y establecido en el pulmón.
Según explica la nota de prensa del CIC, recogida por SINC, la eliminación de la proteína R-Ras2/TC21 implicada en dicha ruta bloquea el desarrollo de estos dos procesos malignos.
El trabajo, publicado en Nature Communications, ha contado con la colaboración de los grupos de investigación liderados por Balbino Alarcón, del Centro de Biología Molecular Severo Ochoa de Madrid, y Mercedes Dosil, del Centro de Investigación del Cáncer de Salamanca.
R-Ras2 y cáncer de mama
R-Ras2, también denominada TC21, es una proteína muy parecida a los miembros de la familia Ras. Estos genes suelen mutar y estar implicados en el desarrollo del cáncer. Esto hizo sospechar a los investigadores que debería tener un papel fundamental en el desarrollo de tumores y, por tanto, representar una potencial para el desarrollo de nuevos fármacos.
El nuevo estudio ha confirmado esta idea ya que, utilizando diversos modelos experimentales en ratón, se demostró que la eliminación de la proteína R-Ras2 provocaba un freno en el crecimiento de tumores de mama y, además, un bloqueo en el desarrollo de metástasis en pulmón.
Asimismo, el trabajo muestra también que la eliminación de esta proteína afecta por igual al desarrollo y propiedades metastásicas de dos de los subtipos más frecuentes de tumores de mama, los conocidos por Her2 positivos y los triple negativos. Estos últimos son, actualmente, los más difíciles de tratar en la práctica clínica debido a su alta malignidad.
El problema de la resistencia
Este estudio también permitió descubrir que la inactivación crónica de esta proteína puede dar lugar a la aparición de fenómenos de resistencia en tumores de mama a muy largo plazo.
Este es un problema habitual en la clínica y que da lugar a la generación de tumores resistentes a las terapias aplicadas o, alternativamente, a la recurrencia de los mismos tras la finalización de los tratamientos antitumorales.
Dado que los autores han identificado también los mecanismos moleculares por los que se produce dicha resistencia, los datos obtenidos permitirán el desarrollo de estrategias terapéuticas para prevenirla.
En un trabajo previo realizado también conjuntamente por Bustelo y Alarcón, se había demostrado que la eliminación de esta proteína en ratones sanos no inducía ningún efecto colateral o enfermedad, lo que sugiere que futuras terapias basadas en la inactivación de la ruta de R-Ras2 no darán lugar a efectos colaterales perniciosos en pacientes.
Como apunta Bustelo, “este trabajo nos permite predecir tanto los aspectos positivos como negativos que se derivarán de la eliminación de esta proteína en tumores de mama. La ventaja es que hemos aprendido también cómo combatir los aspectos negativos derivados de su desactivación”.
Un reto pendiente es saber si la desactivación de esta proteína puede contribuir a frenar otros tipos de tumores. Usando estrategias similares a las del presente estudio, “hemos visto que no es así en algún tipo de tumor como el de piel o colon, pero sí hay resultados preliminares positivos en otros como el linfoma”, concluye Bustelo.
Este estudio también permitió descubrir que la inactivación crónica de esta proteína puede dar lugar a la aparición de fenómenos de resistencia en tumores de mama a muy largo plazo.
Este es un problema habitual en la clínica y que da lugar a la generación de tumores resistentes a las terapias aplicadas o, alternativamente, a la recurrencia de los mismos tras la finalización de los tratamientos antitumorales.
Dado que los autores han identificado también los mecanismos moleculares por los que se produce dicha resistencia, los datos obtenidos permitirán el desarrollo de estrategias terapéuticas para prevenirla.
En un trabajo previo realizado también conjuntamente por Bustelo y Alarcón, se había demostrado que la eliminación de esta proteína en ratones sanos no inducía ningún efecto colateral o enfermedad, lo que sugiere que futuras terapias basadas en la inactivación de la ruta de R-Ras2 no darán lugar a efectos colaterales perniciosos en pacientes.
Como apunta Bustelo, “este trabajo nos permite predecir tanto los aspectos positivos como negativos que se derivarán de la eliminación de esta proteína en tumores de mama. La ventaja es que hemos aprendido también cómo combatir los aspectos negativos derivados de su desactivación”.
Un reto pendiente es saber si la desactivación de esta proteína puede contribuir a frenar otros tipos de tumores. Usando estrategias similares a las del presente estudio, “hemos visto que no es así en algún tipo de tumor como el de piel o colon, pero sí hay resultados preliminares positivos en otros como el linfoma”, concluye Bustelo.
Referencia bibliográfica:
Romain M. Larive, Giulia Moriggi, Mauricio Menacho-Márquez, Marta Cañamero, Enrique de Álava, Balbino Alarcón, Mercedes Dosil y Xosé R. Bustelo: Contribution of the R-Ras2 GTP-binding protein to primary breast tumorigenesis and late-stage metastatic disease. Nature Communications (2014). doi:10.1038/ncomms4881
Romain M. Larive, Giulia Moriggi, Mauricio Menacho-Márquez, Marta Cañamero, Enrique de Álava, Balbino Alarcón, Mercedes Dosil y Xosé R. Bustelo: Contribution of the R-Ras2 GTP-binding protein to primary breast tumorigenesis and late-stage metastatic disease. Nature Communications (2014). doi:10.1038/ncomms4881

 Tendencias Científicas
Tendencias Científicas

 El corazón débil también daña al cerebro
El corazón débil también daña al cerebro CIENCIA ON LINE
CIENCIA ON LINE