Las tecnologías de "captura de carbono", que sirven para atrapar químicamente el dióxido de carbono (CO2) antes de que sea liberado a la atmósfera, están a la orden del día.
Un equipo de investigación de la Universidad de Cornell (EEUU) ha hallado un método innovador para capturar gases de efecto invernadero y utilizarlos como un producto útil, mientras se produce energía eléctrica.
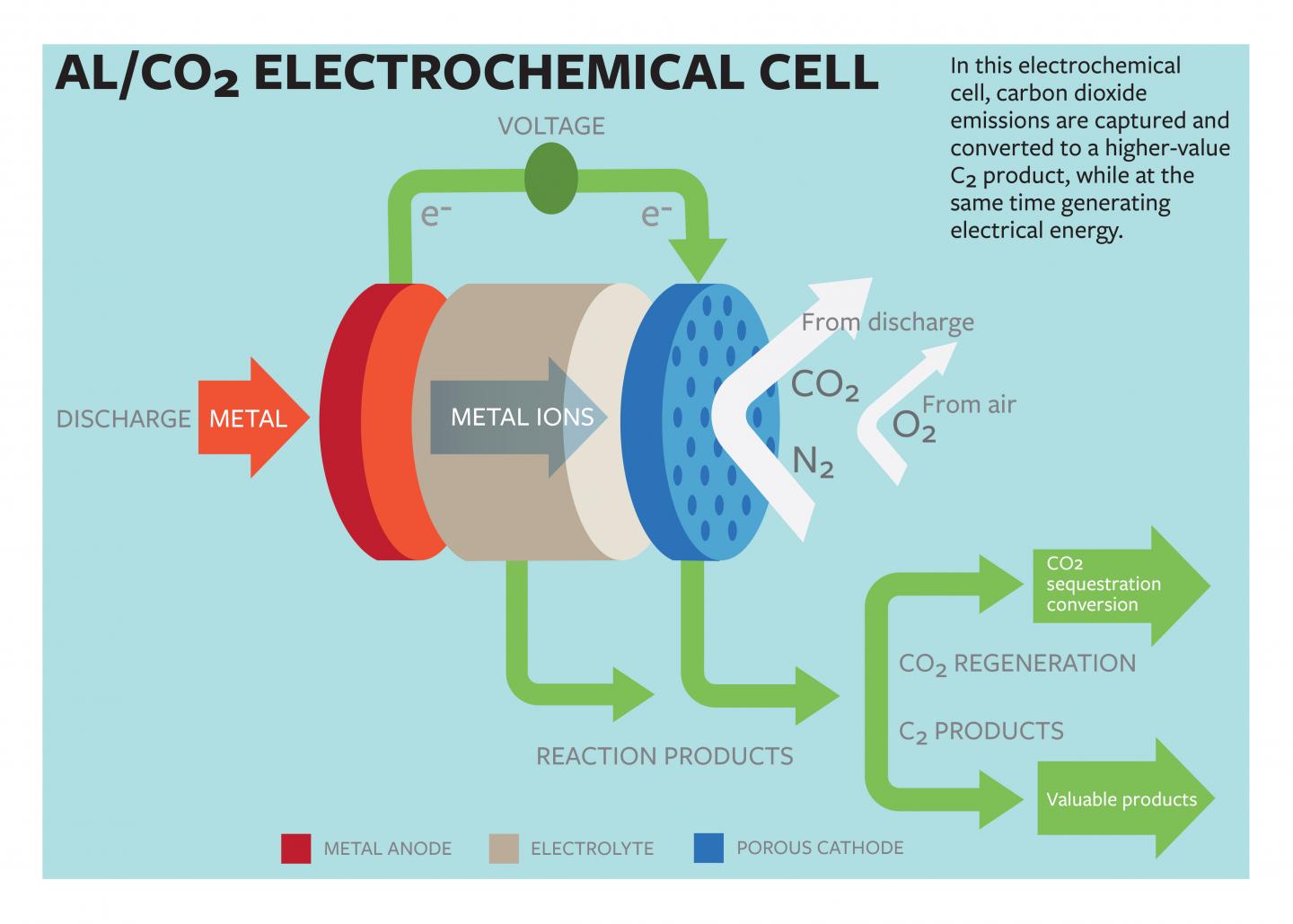
Lynden Archer, profesor en química bio-molecular e ingeniero, y el estudiante de doctorado Wajdi Al Sadat han desarrollado unas células de energía de aluminio y dióxido de carbono asistidas con oxígeno que usan reacciones electroquímicas para almacenar el dióxido de carbono y producir electricidad. Su estudio ha sido publicado en la revista Science Advances.
Electricidad y subproductos
La célula propuesta por el grupo usaría aluminio como ánodo, y corrientes mixtas de dióxido de carbono y oxígeno como ingredientes activos de cátodo. Las reacciones electroquímicas entre el ánodo y el cátodo servirían para almacenar el dióxido de carbono en compuestos ricos en carbono mientras que se produce electricidad y un valioso oxalato como un subproducto.
En la mayoría de los modelos de captura de CO2, el carbono es capturado en líquidos o en sólidos, que son calentados o despresurizados para liberar el dióxido de carbono. El gas concentrado debe ser comprimido y transportado a industrias que pueden reutilizarlo, o ser almacenado en el subsuelo. Los hallazgos de este estudio podrían representar un posible cambio de paradigma, indica Archer.
"El hecho de que hallamos diseñado una tecnología que captura dióxido y también genera electricidad es, en sí mismo, importante" apunta. "Uno de los obstáculos de la actual tecnología de captura de dióxido de carbono en centrales de energía eléctrica es que la regeneración de los fluidos utilizados en este proceso utilizan hasta un 25% de la producción de energía de la central en cuestión. Esto limita mucho la viabilidad comercial de estas tecnologías. Además, el dióxido de carbono capturado debe ser transportado a plantas donde puedan ser almacenadas o reutilizadas, lo cual requiere nuevas infraestructuras".
Un equipo de investigación de la Universidad de Cornell (EEUU) ha hallado un método innovador para capturar gases de efecto invernadero y utilizarlos como un producto útil, mientras se produce energía eléctrica.
Lynden Archer, profesor en química bio-molecular e ingeniero, y el estudiante de doctorado Wajdi Al Sadat han desarrollado unas células de energía de aluminio y dióxido de carbono asistidas con oxígeno que usan reacciones electroquímicas para almacenar el dióxido de carbono y producir electricidad. Su estudio ha sido publicado en la revista Science Advances.
Electricidad y subproductos
La célula propuesta por el grupo usaría aluminio como ánodo, y corrientes mixtas de dióxido de carbono y oxígeno como ingredientes activos de cátodo. Las reacciones electroquímicas entre el ánodo y el cátodo servirían para almacenar el dióxido de carbono en compuestos ricos en carbono mientras que se produce electricidad y un valioso oxalato como un subproducto.
En la mayoría de los modelos de captura de CO2, el carbono es capturado en líquidos o en sólidos, que son calentados o despresurizados para liberar el dióxido de carbono. El gas concentrado debe ser comprimido y transportado a industrias que pueden reutilizarlo, o ser almacenado en el subsuelo. Los hallazgos de este estudio podrían representar un posible cambio de paradigma, indica Archer.
"El hecho de que hallamos diseñado una tecnología que captura dióxido y también genera electricidad es, en sí mismo, importante" apunta. "Uno de los obstáculos de la actual tecnología de captura de dióxido de carbono en centrales de energía eléctrica es que la regeneración de los fluidos utilizados en este proceso utilizan hasta un 25% de la producción de energía de la central en cuestión. Esto limita mucho la viabilidad comercial de estas tecnologías. Además, el dióxido de carbono capturado debe ser transportado a plantas donde puedan ser almacenadas o reutilizadas, lo cual requiere nuevas infraestructuras".
Otro punto clave
El grupo indica que su célula electroquímica general 13 amperios por hora por gramo de carbono poroso (como el cátodo) a una potencial descarga de 1,4 voltios. La energía producida por la célula es comparable a la producida por los mayores sistemas de batería de densidad de energía.
Otro punto clave de sus investigaciones, según indica Archer, es en la generación de intermedios de superóxido, que son formados cuando el dióxido se reduce al cátodo. El superóxido reacciona con dióxido de carbono normalmente inerte formando un oxalato de carbono-carbono que se utiliza en numerosas industrias como la farmacéutica, la fibra y la fundición de metal.
"Un proceso capaz de convertir dióxido de carbono en una molécula más reactiva como un oxalato que contiene dos carbonos da lugar a una reacción en cadena de procesos que pueden ser utilizados para sintetizar una gran variedad de productos" explica Archer, señalando de que la configuración de la electroquímica celular depende del producto que se elija para hacer el oxalato.
Al Sadat, quién ha trabajado en la captura de carbono en vehículos en Saudi Aramco, indica que esta tecnología no está limitada a las aplicaciones de las centrales eléctricas. "Funciona realmente bien en captura a bordo en vehículos", dice, "especialmente si pensamos en un motor de combustión interna y un sistema auxiliar que depende de la energía eléctrica".
Comenta que el aluminio es el perfecto ánodo para esta célula, ya que es abundante, más segura que otros metales de alta densidad y energía y que, además, es más económico que otros materiales como el litio o el sodio mientras que tiene una densidad de energía comparable a la del litio. Ha añadido que muchas industrias especializadas en aluminio ya están incorporando algunos tipos de instalaciones de generación de energía en sus operaciones, por lo que esta tecnología podría ayudar tanto en la generación de energía como en la reducción de carbono.
Un inconveniente de esta tecnología es que el electrólito, el líquido que conecta el ánodo y el cátodo, es extremadamente sensible al agua y, por ende, a la humedad. Un estudio en curso está dirigido a a estudiar el rendimiento de los sistemas electroquímicos y el uso de electrólitos que son menos sensibles al agua.
El grupo indica que su célula electroquímica general 13 amperios por hora por gramo de carbono poroso (como el cátodo) a una potencial descarga de 1,4 voltios. La energía producida por la célula es comparable a la producida por los mayores sistemas de batería de densidad de energía.
Otro punto clave de sus investigaciones, según indica Archer, es en la generación de intermedios de superóxido, que son formados cuando el dióxido se reduce al cátodo. El superóxido reacciona con dióxido de carbono normalmente inerte formando un oxalato de carbono-carbono que se utiliza en numerosas industrias como la farmacéutica, la fibra y la fundición de metal.
"Un proceso capaz de convertir dióxido de carbono en una molécula más reactiva como un oxalato que contiene dos carbonos da lugar a una reacción en cadena de procesos que pueden ser utilizados para sintetizar una gran variedad de productos" explica Archer, señalando de que la configuración de la electroquímica celular depende del producto que se elija para hacer el oxalato.
Al Sadat, quién ha trabajado en la captura de carbono en vehículos en Saudi Aramco, indica que esta tecnología no está limitada a las aplicaciones de las centrales eléctricas. "Funciona realmente bien en captura a bordo en vehículos", dice, "especialmente si pensamos en un motor de combustión interna y un sistema auxiliar que depende de la energía eléctrica".
Comenta que el aluminio es el perfecto ánodo para esta célula, ya que es abundante, más segura que otros metales de alta densidad y energía y que, además, es más económico que otros materiales como el litio o el sodio mientras que tiene una densidad de energía comparable a la del litio. Ha añadido que muchas industrias especializadas en aluminio ya están incorporando algunos tipos de instalaciones de generación de energía en sus operaciones, por lo que esta tecnología podría ayudar tanto en la generación de energía como en la reducción de carbono.
Un inconveniente de esta tecnología es que el electrólito, el líquido que conecta el ánodo y el cátodo, es extremadamente sensible al agua y, por ende, a la humedad. Un estudio en curso está dirigido a a estudiar el rendimiento de los sistemas electroquímicos y el uso de electrólitos que son menos sensibles al agua.
Referencia bibliográfica:
W. I. Al Sadat, L. A. Archer. The O2-assisted Al/CO2 electrochemical cell: A system for CO2 capture/conversion and electric power generation. Science Advances (2016). DOI: 10.1126/sciadv.1600968.
W. I. Al Sadat, L. A. Archer. The O2-assisted Al/CO2 electrochemical cell: A system for CO2 capture/conversion and electric power generation. Science Advances (2016). DOI: 10.1126/sciadv.1600968.

 Tendencias Científicas
Tendencias Científicas

 La Inteligencia Artificial puede ver a través del espejo
La Inteligencia Artificial puede ver a través del espejo CIENCIA ON LINE
CIENCIA ON LINE