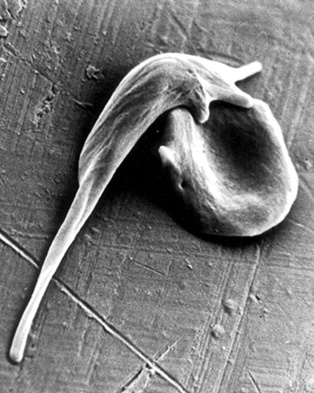
Las células enfermas de la anemia de células falciformes tienen una característica forma de hoz. Imagen: Frans Kuypers. Fuente: Hospital Benioff.
Un equipo de médicos y científicos de laboratorio ha dado un paso clave hacia una cura para la anemia de células falciformes, mediante el método de edición genética Crispr-Cas9, para arreglar el gen mutado responsable de la enfermedad en las células madre de la sangre de los pacientes afectados.
Por primera vez, han corregido la mutación en una proporción de células madre suficientemente alta para producir un beneficio sustancial en los pacientes de esta enfermedad.
La anemia de células falciformes es una enfermedad genética recesiva causada por una sola mutación en ambas copias de un gen que codifica la beta-globina, una proteína que forma parte de la hemoglobina, molécula que transporta el oxígeno. Este defecto en hace que las moléculas de hemoglobina permanezcan juntas, deformando las células rojas de la sangre en una forma característica de hoz.
Estas células deformes se atascan en los vasos sanguíneos, causando bloqueos, anemia, dolor, insuficiencia en los órganos y una esperanza de vida significativamente menor. Es particularmente frecuente en los afroamericanos y la población del África subsahariana, y afecta a cientos de miles de personas en todo el mundo.
Los investigadores de la Universidad de Berkeley, del Instituto de Investigación Oakland del Hospìtal Infantil Benioff de la Universidad de California en San Francisco y de la Universidad de Utah (EE.UU.) esperan reinfundir a los pacientes las células madre editadas y aliviar los síntomas de la enfermedad.
Según Jacob Corn, autor principal del estudio y director científico de la Iniciativa de Genómica Innovadora en UC Berkeley, "todavía hay mucho trabajo por hacer antes de que este enfoque pueda ser utilizado a nivel clínico, pero tenemos la esperanza de que allane el camino para nuevos tipos de tratamiento para estos pacientes."
En pruebas con ratones, las células madre genéticamente modificadas se mantenían por lo menos hasta cuatro meses después del trasplante, una referencia importante para asegurar que cualquier terapia potencial vaya a ser duradera.
"Es un avance importante porque por primera vez se muestra un nivel de corrección en las células madre que debería ser suficiente para un beneficio clínico en estos pacientes", dice el co-autor Mark Walters, hematólogo pediátrico y oncólogo. Los resultados se han publicado en la revista en línea Science Translational Medicine.
El objetivo del equipo es desarrollar métodos basados en la ingeniería del genoma para corregir la mutación causante de la enfermedad en las propias células madre de cada paciente, para garantizar que las nuevas células rojas de la sangre estén sanas.
Por primera vez, han corregido la mutación en una proporción de células madre suficientemente alta para producir un beneficio sustancial en los pacientes de esta enfermedad.
La anemia de células falciformes es una enfermedad genética recesiva causada por una sola mutación en ambas copias de un gen que codifica la beta-globina, una proteína que forma parte de la hemoglobina, molécula que transporta el oxígeno. Este defecto en hace que las moléculas de hemoglobina permanezcan juntas, deformando las células rojas de la sangre en una forma característica de hoz.
Estas células deformes se atascan en los vasos sanguíneos, causando bloqueos, anemia, dolor, insuficiencia en los órganos y una esperanza de vida significativamente menor. Es particularmente frecuente en los afroamericanos y la población del África subsahariana, y afecta a cientos de miles de personas en todo el mundo.
Los investigadores de la Universidad de Berkeley, del Instituto de Investigación Oakland del Hospìtal Infantil Benioff de la Universidad de California en San Francisco y de la Universidad de Utah (EE.UU.) esperan reinfundir a los pacientes las células madre editadas y aliviar los síntomas de la enfermedad.
Según Jacob Corn, autor principal del estudio y director científico de la Iniciativa de Genómica Innovadora en UC Berkeley, "todavía hay mucho trabajo por hacer antes de que este enfoque pueda ser utilizado a nivel clínico, pero tenemos la esperanza de que allane el camino para nuevos tipos de tratamiento para estos pacientes."
En pruebas con ratones, las células madre genéticamente modificadas se mantenían por lo menos hasta cuatro meses después del trasplante, una referencia importante para asegurar que cualquier terapia potencial vaya a ser duradera.
"Es un avance importante porque por primera vez se muestra un nivel de corrección en las células madre que debería ser suficiente para un beneficio clínico en estos pacientes", dice el co-autor Mark Walters, hematólogo pediátrico y oncólogo. Los resultados se han publicado en la revista en línea Science Translational Medicine.
El objetivo del equipo es desarrollar métodos basados en la ingeniería del genoma para corregir la mutación causante de la enfermedad en las propias células madre de cada paciente, para garantizar que las nuevas células rojas de la sangre estén sanas.
El método
El equipo utilizó el método Crispr-Cas9 para corregir la mutación causante de la enfermedad en las células madre hematopoyéticas -células precursoras que maduran y se transforman en las células rojas de la sangre- aisladas a partir de sangre entera de pacientes con anemia drepanocítica (otro nombre de la enfermedad). Las células corregidas produjeron hemoglobina sana, mientras que las mutadas no la producen en absoluto.
El trabajo preclínico futuro requerirá más optimización, estudios en ratones a gran escala y un análisis riguroso de seguridad, subrayan los investigadores. Corn y su laboratorio se han unido con Walters, experto en el desarrollo de tratamientos curativos como el trasplante de médula ósea y la terapia génica para la anemia de células falciformes, para iniciar un ensayo clínico en fase temprana de este nuevo tratamiento en de los próximos cinco años.
Los grupos de investigación podrían aplicar este enfoque a otras enfermedades de la sangre, como β-talasemia, inmunodeficiencia combinada severa, enfermedad granulomatosa crónica, o trastornos poco comunes como el síndrome de Wiskott-Aldrich y la anemia de Fanconi, e incluso la infección por VIH.
"La anemia de células falciformes es sólo uno de muchos trastornos de la sangre causados por una sola mutación en el genoma", dice Corn, en la información de UC Berkeley. "Es muy posible que otros investigadores y médicos puedan utilizar este tipo de edición génica para explorar maneras de curar un gran número de enfermedades."
El equipo utilizó el método Crispr-Cas9 para corregir la mutación causante de la enfermedad en las células madre hematopoyéticas -células precursoras que maduran y se transforman en las células rojas de la sangre- aisladas a partir de sangre entera de pacientes con anemia drepanocítica (otro nombre de la enfermedad). Las células corregidas produjeron hemoglobina sana, mientras que las mutadas no la producen en absoluto.
El trabajo preclínico futuro requerirá más optimización, estudios en ratones a gran escala y un análisis riguroso de seguridad, subrayan los investigadores. Corn y su laboratorio se han unido con Walters, experto en el desarrollo de tratamientos curativos como el trasplante de médula ósea y la terapia génica para la anemia de células falciformes, para iniciar un ensayo clínico en fase temprana de este nuevo tratamiento en de los próximos cinco años.
Los grupos de investigación podrían aplicar este enfoque a otras enfermedades de la sangre, como β-talasemia, inmunodeficiencia combinada severa, enfermedad granulomatosa crónica, o trastornos poco comunes como el síndrome de Wiskott-Aldrich y la anemia de Fanconi, e incluso la infección por VIH.
"La anemia de células falciformes es sólo uno de muchos trastornos de la sangre causados por una sola mutación en el genoma", dice Corn, en la información de UC Berkeley. "Es muy posible que otros investigadores y médicos puedan utilizar este tipo de edición génica para explorar maneras de curar un gran número de enfermedades."
Referencia bibliográfica:
M. A. DeWitt, W. Magis, N. L. Bray, T. Wang, J. R. Berman, F. Urbinati, S.-J. Heo, T. Mitros, D. P. Munoz, D. Boffelli, D. B. Kohn, M. C. Walters, D. Carroll, D. I. K. Martin, J. E. Corn: Selection-free genome editing of the sickle mutation in human adult hematopoietic stem/progenitor cells. Science Translational Medicine (2016). DOI: 10.1126/scitranslmed.aaf9336
M. A. DeWitt, W. Magis, N. L. Bray, T. Wang, J. R. Berman, F. Urbinati, S.-J. Heo, T. Mitros, D. P. Munoz, D. Boffelli, D. B. Kohn, M. C. Walters, D. Carroll, D. I. K. Martin, J. E. Corn: Selection-free genome editing of the sickle mutation in human adult hematopoietic stem/progenitor cells. Science Translational Medicine (2016). DOI: 10.1126/scitranslmed.aaf9336

 Tendencias Científicas
Tendencias Científicas

 El corazón débil también daña al cerebro
El corazón débil también daña al cerebro CIENCIA ON LINE
CIENCIA ON LINE