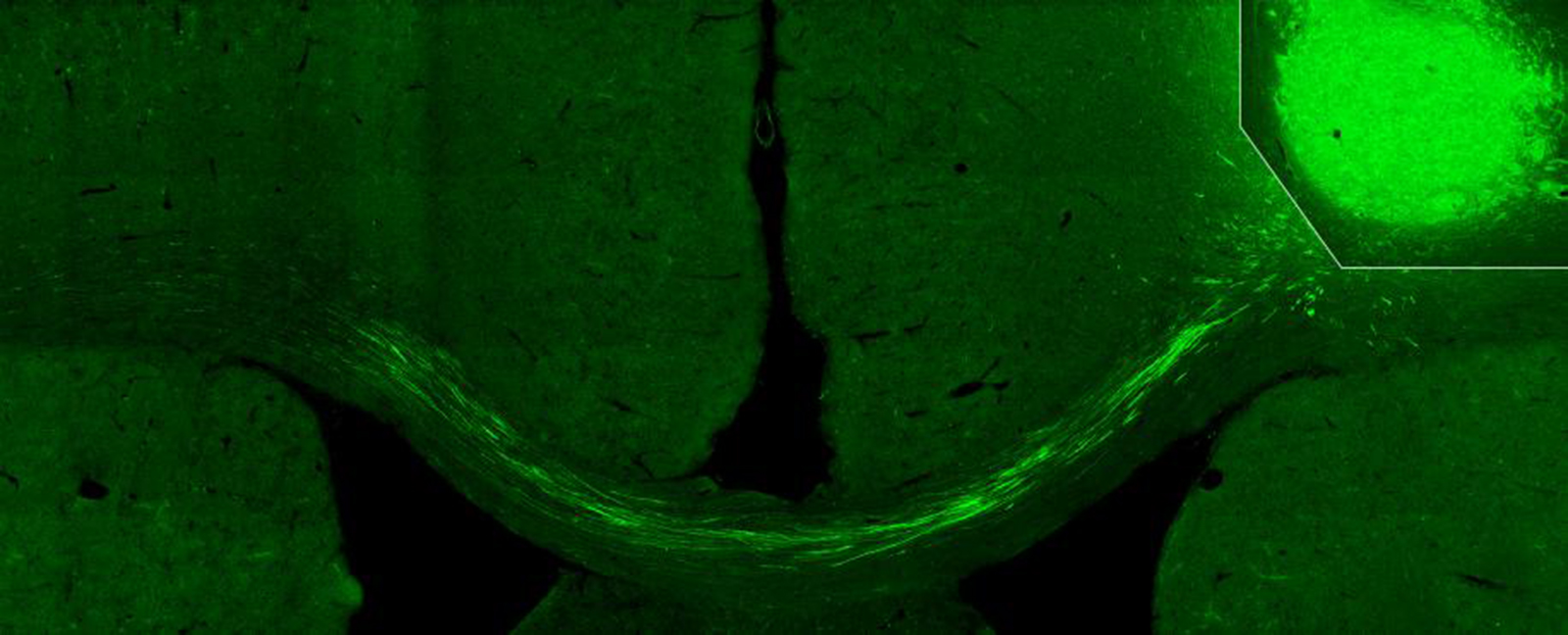
Fibras provenientes de las neuronas corticales derivadas de los precursores humanos trasplantados (arriba a la derecha) llegando al lado contralateral de la corteza cerebral de la rata. Crédito: Tornero et al.
Un equipo de investigadores de la Universidad de Lund en Suecia, del que forman parte dos científicos españoles, ha logrado restaurar la movilidad y la sensación del tacto en ratas afectadas por un ictus isquémico.
El ictus isquémico representa el 80 por ciento de los accidentes cerebrovasculares que se producen en la actualidad y está causado por la oclusión de una arteria cerebral.
Esta obstrucción provoca la disminución del riego sanguíneo en los centros neuronales que dirigen las funciones del organismo, abocándolo a la incapacidad o a la muerte.
Reprogramando células
La restauración de las movilidad y sensación del tacto en ratas afectadas por un ictus isquémico la consiguieron los investigadores reprogramando células humanas obtenidas de la piel.
Esta reprogramación convirtió estas células en neuronas que luego se trasplantaron al cerebro de las ratas.
"Seis meses después del trasplante, pudimos ver cómo las nuevas células habían reparado el daño que había causado un ictus isquémico en el cerebro de las ratas", explica uno de los autores de la Universidad de Lund, Zaal Kokaia, en un comunicado.
Estudios previos habían demostrado que es posible trasplantar células nerviosas derivadas de células madre humanas, o de células reprogramadas, en cerebros de ratas afectadas por un accidente cerebrovascular.
Sin embargo, no se sabía si las células trasplantadas pueden formar conexiones correctamente en el cerebro de la rata de tal manera que restablezca el movimiento y el tacto normales, que es el resultado obtenido en la nueva investigación, publicada en PNAS.
Comprobado: funciona
“El artículo que publicado en PNAS es el último de una serie de tres. Los dos primeros se publicaron en la Revisa Brain en 2013 y 2017. En ellos, exploramos el uso de terapia celular usando células madre para la reparación del cerebro tras sufrir un ictus isquémico”, explica a Tendencias21 el profesor de la Universidad de Barcelona y coautor del artículo, Daniel Tornero.
Y añade: “En conjunto, hemos demostrado, usando un modelo en rata, que neuronas humanas generadas a partir de células de la piel reprogramadas hasta células madre son capaces de integrarse en el cerebro tras un ictus, mejorando la recuperación del daño y regenerando la región dañada tras el accidente cerebrovascular.”
Asimismo, señala Tornero, “el aspecto más importante del trabajo que se acaba de publicar es que hemos sido los primeros a nivel mundial que demuestran que las células trasplantadas son capaces de reconstruir el circuito cerebral dañado durante la lesión isquémica, reemplazando a las neuronas perdidas”.
Por último, explica que “hemos usado, entre otras técnicas, una herramienta denominada optogenética, que nos permite controlar la actividad de las neuronas trasplantadas dentro del cerebro iluminándolas con luz de un determinado color”.
El ictus isquémico representa el 80 por ciento de los accidentes cerebrovasculares que se producen en la actualidad y está causado por la oclusión de una arteria cerebral.
Esta obstrucción provoca la disminución del riego sanguíneo en los centros neuronales que dirigen las funciones del organismo, abocándolo a la incapacidad o a la muerte.
Reprogramando células
La restauración de las movilidad y sensación del tacto en ratas afectadas por un ictus isquémico la consiguieron los investigadores reprogramando células humanas obtenidas de la piel.
Esta reprogramación convirtió estas células en neuronas que luego se trasplantaron al cerebro de las ratas.
"Seis meses después del trasplante, pudimos ver cómo las nuevas células habían reparado el daño que había causado un ictus isquémico en el cerebro de las ratas", explica uno de los autores de la Universidad de Lund, Zaal Kokaia, en un comunicado.
Estudios previos habían demostrado que es posible trasplantar células nerviosas derivadas de células madre humanas, o de células reprogramadas, en cerebros de ratas afectadas por un accidente cerebrovascular.
Sin embargo, no se sabía si las células trasplantadas pueden formar conexiones correctamente en el cerebro de la rata de tal manera que restablezca el movimiento y el tacto normales, que es el resultado obtenido en la nueva investigación, publicada en PNAS.
Comprobado: funciona
“El artículo que publicado en PNAS es el último de una serie de tres. Los dos primeros se publicaron en la Revisa Brain en 2013 y 2017. En ellos, exploramos el uso de terapia celular usando células madre para la reparación del cerebro tras sufrir un ictus isquémico”, explica a Tendencias21 el profesor de la Universidad de Barcelona y coautor del artículo, Daniel Tornero.
Y añade: “En conjunto, hemos demostrado, usando un modelo en rata, que neuronas humanas generadas a partir de células de la piel reprogramadas hasta células madre son capaces de integrarse en el cerebro tras un ictus, mejorando la recuperación del daño y regenerando la región dañada tras el accidente cerebrovascular.”
Asimismo, señala Tornero, “el aspecto más importante del trabajo que se acaba de publicar es que hemos sido los primeros a nivel mundial que demuestran que las células trasplantadas son capaces de reconstruir el circuito cerebral dañado durante la lesión isquémica, reemplazando a las neuronas perdidas”.
Por último, explica que “hemos usado, entre otras técnicas, una herramienta denominada optogenética, que nos permite controlar la actividad de las neuronas trasplantadas dentro del cerebro iluminándolas con luz de un determinado color”.
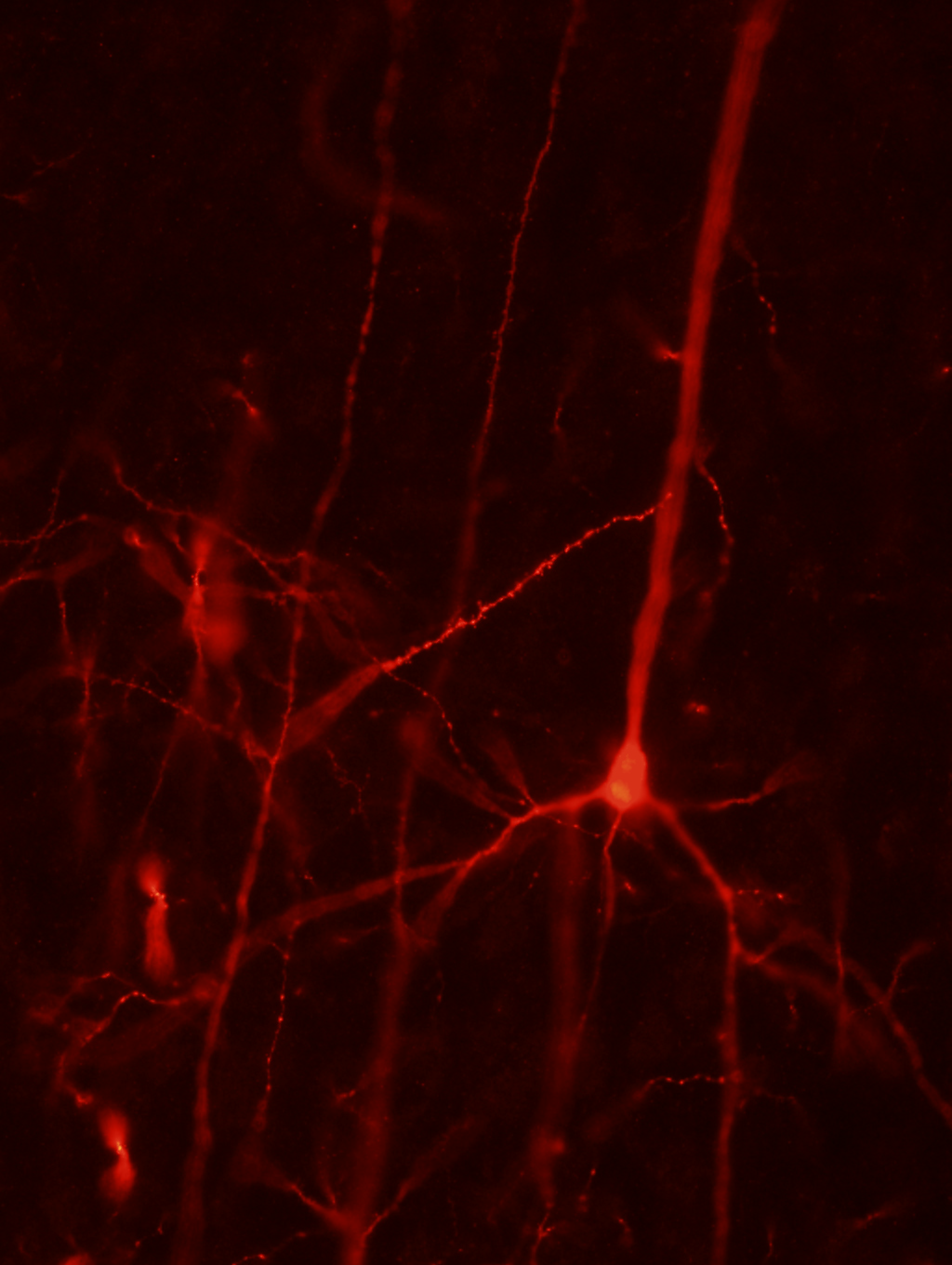
Neuronas piramidales en el hemisferio contralateral que conectan con las neuronas corticales derivadas de los precursores humanos trasplantados. Crédito: Tornero el al.
Resultados prometedores
Los resultados son prometedores, tal como señalan los investigadores en el artículo publicado en PNAS, si bien se necesitan más estudios para su eventual aplicación clínica.
"Queremos saber más sobre cómo las células trasplantadas afectan el hemisferio opuesto del cerebro. También queremos ver más de cerca cómo un trasplante afecta las funciones intelectuales como la memoria. Además, estudiaremos los posibles efectos secundarios. La seguridad es, por supuesto, extremadamente importante para el trasplante de células si se va a usar clínicamente en el futuro”, concluye Zaal Kokaia.
La investigación se ha desarrollado en el laboratorio de Zaal Kokaia, Universidad de Lund, y en ella han participado, además de Daniel Tornero, la también española Sara Palma-Tortosa y un amplio equipo de expertos procedentes de Ucrania, Georgia y Estados Unidos.
(Versión actualizada con declaraciones exclusivas de uno de los autores y una aclaración importante sobre el resultado de esta investigación).
Los resultados son prometedores, tal como señalan los investigadores en el artículo publicado en PNAS, si bien se necesitan más estudios para su eventual aplicación clínica.
"Queremos saber más sobre cómo las células trasplantadas afectan el hemisferio opuesto del cerebro. También queremos ver más de cerca cómo un trasplante afecta las funciones intelectuales como la memoria. Además, estudiaremos los posibles efectos secundarios. La seguridad es, por supuesto, extremadamente importante para el trasplante de células si se va a usar clínicamente en el futuro”, concluye Zaal Kokaia.
La investigación se ha desarrollado en el laboratorio de Zaal Kokaia, Universidad de Lund, y en ella han participado, además de Daniel Tornero, la también española Sara Palma-Tortosa y un amplio equipo de expertos procedentes de Ucrania, Georgia y Estados Unidos.
(Versión actualizada con declaraciones exclusivas de uno de los autores y una aclaración importante sobre el resultado de esta investigación).
Referencias
Activity in grafted human iPS cell–derived cortical neurons integrated in stroke-injured rat brain regulates motor behavior. Sara Palma-Tortosa et al. PNAS, April 6, 2020. DOI:https://doi.org/10.1073/pnas.2000690117
Human induced pluripotent stem cell-derived cortical neurons integrate in stroke-injured cortex and improve functional recovery. Tornero D. et al. Brain. 2013 Dec;136 (Pt 12):3561-77. DOI: 10.1093/brain/awt278. Epub 2013 Oct 21.
Synaptic inputs from stroke-injured brain to grafted human stem cell-derived neurons activated by sensory stimuli. Tornero D. et al. Brain. 2017 Mar 1;140(3):692-706. doi:10.1093/brain/aww347.
Activity in grafted human iPS cell–derived cortical neurons integrated in stroke-injured rat brain regulates motor behavior. Sara Palma-Tortosa et al. PNAS, April 6, 2020. DOI:https://doi.org/10.1073/pnas.2000690117
Human induced pluripotent stem cell-derived cortical neurons integrate in stroke-injured cortex and improve functional recovery. Tornero D. et al. Brain. 2013 Dec;136 (Pt 12):3561-77. DOI: 10.1093/brain/awt278. Epub 2013 Oct 21.
Synaptic inputs from stroke-injured brain to grafted human stem cell-derived neurons activated by sensory stimuli. Tornero D. et al. Brain. 2017 Mar 1;140(3):692-706. doi:10.1093/brain/aww347.

 Tendencias Científicas
Tendencias Científicas

 Los electrones abren un nuevo mundo a la física cuántica
Los electrones abren un nuevo mundo a la física cuántica CIENCIA ON LINE
CIENCIA ON LINE