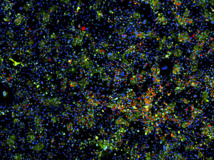
En la imagen, las manchas verdes identifican a las células del hígado, y las rojas a las células que se están dividiendo activamente. Imagen: Shan et. Al. Nature Chemical Biology. Fuente: MIT.
Los científicos ya sabían que el hígado puede regenerarse si se elimina una parte de él. Por eso, algunos han intentado explotar esa capacidad con la esperanza de producir tejido hepático artificial para trasplantes.
Sin embargo, existe un importante obstáculo: las células hepáticas maduras o hepatocitos pierden rápidamente su funcionamiento normal cuando son sustraídas del cuerpo. Ahora, investigadores del Instituto Tecnológico de Massachusetts (MIT) han logrado un importante avance para superar este escollo.
Según publica el MIT en un comunicado, lo que han hecho los científicos es identificar una docena de compuestos químicos que pueden ayudar a las células del hígado no sólo a mantener su función normal en laboratorio, sino también a multiplicarse para producir nuevo tejido.
Las células así cultivadas podrían ayudar al desarrollo de una ingeniería tisular que permita el tratamiento de los 500 millones de personas que sufren de enfermedades crónicas del hígado, como la hepatitis C, aseguran los científicos. El logro ha aparecido publicado en la revista Nature Chemical Biology.
Doce compuestos identificados
El autor principal del artículo de Nature Chemical Biology ha sido Jing (Meghan) Shan. El avance fue realizado en el laboratorio de la ingeniero Sangeeta Bhatia, con la colaboración de científicos del Broad Institute del Mit y de Harvard, de la Escuela de Medicina de Harvard y de la Universidad de Wisconsin (EEUU).
Bhatia había desarrollado previamente un sistema que permitía mantener la función de las células hepáticas durante un tiempo, tras separarlas del cuerpo. Lo hizo mezclándolas con precisión con fibroblastos o células fijas de ratón, que son células residentes del tejido conectivo.
Para el presente estudio, los investigadores adaptaron esta misma metodología, de tal manera que las células hepáticas pudieran crecer, en recipientes de laboratorio, en capas formadas con fibroblastos. La técnica dio tiempo a los científicos de llevar a cabo análisis a gran escala sobre el efecto de un total de 12.500 sustancias químicas distintas sobre el crecimiento y el funcionamiento de dichas células.
El hígado desarrolla cerca de 500 funciones, que están divididas en cuatro categorías generales: desintoxicación, metabolismo energético, síntesis de proteínas y producción de bilis.
David Thomas, del Broad Institute, midió los niveles medios de expresión de 83 enzimas hepáticas con algunas de las funciones del hígado más difíciles de conservar fuera del cuerpo. Tras cribar miles de células hepáticas de ocho donantes distintos de tejidos, los investigadores identificaron 12 compuestos que ayudaron a las células a mantener estas funciones, a promover la división celular o a ambas cosas.
Sin embargo, existe un importante obstáculo: las células hepáticas maduras o hepatocitos pierden rápidamente su funcionamiento normal cuando son sustraídas del cuerpo. Ahora, investigadores del Instituto Tecnológico de Massachusetts (MIT) han logrado un importante avance para superar este escollo.
Según publica el MIT en un comunicado, lo que han hecho los científicos es identificar una docena de compuestos químicos que pueden ayudar a las células del hígado no sólo a mantener su función normal en laboratorio, sino también a multiplicarse para producir nuevo tejido.
Las células así cultivadas podrían ayudar al desarrollo de una ingeniería tisular que permita el tratamiento de los 500 millones de personas que sufren de enfermedades crónicas del hígado, como la hepatitis C, aseguran los científicos. El logro ha aparecido publicado en la revista Nature Chemical Biology.
Doce compuestos identificados
El autor principal del artículo de Nature Chemical Biology ha sido Jing (Meghan) Shan. El avance fue realizado en el laboratorio de la ingeniero Sangeeta Bhatia, con la colaboración de científicos del Broad Institute del Mit y de Harvard, de la Escuela de Medicina de Harvard y de la Universidad de Wisconsin (EEUU).
Bhatia había desarrollado previamente un sistema que permitía mantener la función de las células hepáticas durante un tiempo, tras separarlas del cuerpo. Lo hizo mezclándolas con precisión con fibroblastos o células fijas de ratón, que son células residentes del tejido conectivo.
Para el presente estudio, los investigadores adaptaron esta misma metodología, de tal manera que las células hepáticas pudieran crecer, en recipientes de laboratorio, en capas formadas con fibroblastos. La técnica dio tiempo a los científicos de llevar a cabo análisis a gran escala sobre el efecto de un total de 12.500 sustancias químicas distintas sobre el crecimiento y el funcionamiento de dichas células.
El hígado desarrolla cerca de 500 funciones, que están divididas en cuatro categorías generales: desintoxicación, metabolismo energético, síntesis de proteínas y producción de bilis.
David Thomas, del Broad Institute, midió los niveles medios de expresión de 83 enzimas hepáticas con algunas de las funciones del hígado más difíciles de conservar fuera del cuerpo. Tras cribar miles de células hepáticas de ocho donantes distintos de tejidos, los investigadores identificaron 12 compuestos que ayudaron a las células a mantener estas funciones, a promover la división celular o a ambas cosas.
Maduración de las células hepáticas en laboratorio
Dos de estos compuestos funcionaron especialmente bien con las células de los donantes más jóvenes, por lo que los investigadores también los probaron en células hepáticas generadas a partir de células madre pluripotentes inducidas (iPS), capaces de generar la mayoría de los tejidos.
Ya se había intentado crear hepatocitos a partir de iPSCs antes, pero no se había logrado que estas células hepáticas alcanzasen un estado completamente maduro. Sin embargo, tratadas con ambos compuestos, las células maduraron completamente.
Por esa razón, Bhatia y su equipo se preguntan ahora si estos mismos compuestos podrían activar la maduración celular en otros tipos de células. Por otra parte, en estudios futuros planean implantar en ratones células del hígado desarrolladas dentro de tejidos poliméricos (formados por macromoléculas), con el fin de probar si éstos podrían ser utilizados para sustituir tejidos hepáticos naturales.
También trabajan en el desarrollo de compuestos que ayuden a los tejidos del hígado de pacientes a regenerarse, en este caso con la colaboración de Trista Norte y Wolfram Goessling, de la Harvard Medical School.
Cultivo y trasplante de células
Por otro lado, recientemente Bhatia y sus colaboradores han hecho avances hacia la solución de otro problema de ingeniería de tejido hepático, que es el de conseguir que en el cuerpo del receptor se desarrollen vasos sanguíneos que suministren oxígeno y nutrientes a los nuevos tejidos.
En un artículo publicado por Proceedings of the National Academy of Sciences, Bhatia y Christopher Chen, profesor de la Universidad de Pennsylvania, demostraron que si se incrustan conductos preformados de células endoteliales en el tejido, éstos crecerán rápidamente en forma de matrices de vasos sanguíneos tras el implante tisular.
Para lograr esto, los científicos del laboratorio de Bhatia, trabajaron con Peter Zandstra, de la Universidad de Toronto, en el diseño de un nuevo sistema que permite crear tejido de ingeniería 3-D y controlar con precisión la colocación de diferentes tipos de células dentro de éste.
Este método, que ha sido descrito en Nature Communications, permitiría que el tejido artificial funcionara mejor en conjunción con el tejido huésped.
En general, según Bhatia, todos estos avances “suponen un camino hacia adelante en la resolución de problemas duraderos de la ingeniería de tejidos del hígado: el cultivo de una gran cantidad de células hepáticas fuera del cuerpo y la obtención de tejidos de injerto para el receptor del trasplante”.
Dos de estos compuestos funcionaron especialmente bien con las células de los donantes más jóvenes, por lo que los investigadores también los probaron en células hepáticas generadas a partir de células madre pluripotentes inducidas (iPS), capaces de generar la mayoría de los tejidos.
Ya se había intentado crear hepatocitos a partir de iPSCs antes, pero no se había logrado que estas células hepáticas alcanzasen un estado completamente maduro. Sin embargo, tratadas con ambos compuestos, las células maduraron completamente.
Por esa razón, Bhatia y su equipo se preguntan ahora si estos mismos compuestos podrían activar la maduración celular en otros tipos de células. Por otra parte, en estudios futuros planean implantar en ratones células del hígado desarrolladas dentro de tejidos poliméricos (formados por macromoléculas), con el fin de probar si éstos podrían ser utilizados para sustituir tejidos hepáticos naturales.
También trabajan en el desarrollo de compuestos que ayuden a los tejidos del hígado de pacientes a regenerarse, en este caso con la colaboración de Trista Norte y Wolfram Goessling, de la Harvard Medical School.
Cultivo y trasplante de células
Por otro lado, recientemente Bhatia y sus colaboradores han hecho avances hacia la solución de otro problema de ingeniería de tejido hepático, que es el de conseguir que en el cuerpo del receptor se desarrollen vasos sanguíneos que suministren oxígeno y nutrientes a los nuevos tejidos.
En un artículo publicado por Proceedings of the National Academy of Sciences, Bhatia y Christopher Chen, profesor de la Universidad de Pennsylvania, demostraron que si se incrustan conductos preformados de células endoteliales en el tejido, éstos crecerán rápidamente en forma de matrices de vasos sanguíneos tras el implante tisular.
Para lograr esto, los científicos del laboratorio de Bhatia, trabajaron con Peter Zandstra, de la Universidad de Toronto, en el diseño de un nuevo sistema que permite crear tejido de ingeniería 3-D y controlar con precisión la colocación de diferentes tipos de células dentro de éste.
Este método, que ha sido descrito en Nature Communications, permitiría que el tejido artificial funcionara mejor en conjunción con el tejido huésped.
En general, según Bhatia, todos estos avances “suponen un camino hacia adelante en la resolución de problemas duraderos de la ingeniería de tejidos del hígado: el cultivo de una gran cantidad de células hepáticas fuera del cuerpo y la obtención de tejidos de injerto para el receptor del trasplante”.
Referencias bibliográficas:
Jing Shan, Robert E Schwartz, Nathan T Ross, David J Logan, David Thomas, Stephen A Duncan, Trista E North, Wolfram Goessling, Anne E Carpenter y Sangeeta N Bhatia. Identification of small molecules for human hepatocyte expansion and iPS differentiation. Nature Chemical Biology (2013). DOI: 10.1038/nchembio.1270.
Jan D. Baranski, Ritika R. Chaturvedi, Kelly R. Stevens, Jeroen Eyckmans, Brian Carvalho, Ricardo D. Solorzano, Michael T. Yang, Jordan S. Miller, Sangeeta N. Bhatia, y Christopher S. Chen. Geometric control of vascular networks to enhance engineered tissue integration and function. PNAS (2013).
K. R. Stevens, M. D. Ungrin, R. E. Schwartz, S. Ng, B. Carvalho, K. S. Christine, R. R. Chaturvedi, C. Y. Li, P. W. Zandstra, C. S. Chen y S. N. Bhatia. InVERT molding for scalable control of tissue microarchitecture. Nature Communications (2013). DOI:10.1038/ncomms2853.
Jing Shan, Robert E Schwartz, Nathan T Ross, David J Logan, David Thomas, Stephen A Duncan, Trista E North, Wolfram Goessling, Anne E Carpenter y Sangeeta N Bhatia. Identification of small molecules for human hepatocyte expansion and iPS differentiation. Nature Chemical Biology (2013). DOI: 10.1038/nchembio.1270.
Jan D. Baranski, Ritika R. Chaturvedi, Kelly R. Stevens, Jeroen Eyckmans, Brian Carvalho, Ricardo D. Solorzano, Michael T. Yang, Jordan S. Miller, Sangeeta N. Bhatia, y Christopher S. Chen. Geometric control of vascular networks to enhance engineered tissue integration and function. PNAS (2013).
K. R. Stevens, M. D. Ungrin, R. E. Schwartz, S. Ng, B. Carvalho, K. S. Christine, R. R. Chaturvedi, C. Y. Li, P. W. Zandstra, C. S. Chen y S. N. Bhatia. InVERT molding for scalable control of tissue microarchitecture. Nature Communications (2013). DOI:10.1038/ncomms2853.

 Tendencias Científicas
Tendencias Científicas

 Los electrones abren un nuevo mundo a la física cuántica
Los electrones abren un nuevo mundo a la física cuántica CIENCIA ON LINE
CIENCIA ON LINE