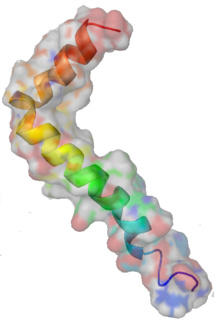
Superficie y estructura secundaria del beta-amiloideatamiento. Imagen: Boku wa Kage. Fuente: Wikipedia.
Científicos del Institute for Research on Biomedecine (IRB) de Barcelona, en colaboración con investigadores de la Universidad de Barcelona, han observado que agrupaciones de entre 20 a 100 unidades del péptido beta amiloide, asociado al Alzheimer, adoptan una cierta estructura que las hace nocivas para las neuronas.
Es la primera vez que una metodología permite seguir el proceso de agregación y al mismo tiempo detectar que un patrón estructural es responsable de la toxicidad de agrupaciones de beta amiloide.
Los investigadores dicen que estos estudios son un paso adelante para encontrar una diana terapéutica para una enfermedad, hoy por hoy, huérfana de medicamentos.
Metodología presentada
El péptido - proteína pequeña - beta amiloide está fuertemente asociado al Alzheimer pero todavía se busca la prueba inequívoca que lo sitúe como la causa principal del origen y el desarrollo de la enfermedad.
El principal escollo para confirmarlo es que la beta amiloide no hace daño cuando está sola, sino cuando se agrupa consigo misma, hasta que forma las denominadas fibras amiloides.
“No tratamos con una única diana, la beta amiloide, sino que las dianas son múltiples, porque cada agrupación de beta amiloide que se forma durante el proceso de agregación, desde dos unidades hasta 3.000, es una diana potencial. Establecer cual de estas agrupaciones es responsable de la muerte neuronal es un reto complejo y es uno de los puntos críticos para corroborar o refutar la hipótesis beta amiloide”, explica Natàlia Carulla, investigadora del Instituto de Investigación Biomédica (IRB Barcelona), y principal responsable del estudio, en un comunicado de dicho Instituto.
En este trabajo, que publica hoy la revista científica ACS Chemical Biology, Carulla y sus colaboradores presentan la metodología que ha permitido por primera vez distinguir diferentes tipos de agrupaciones de beta amiloide durante el proceso de agregación y, en paralelo, establecer cual de ellas es más tóxica.
El estudio aporta más evidencias hacia la hipótesis de que la muerte de neuronas la provocan los agregados intermedios de beta amiloide y revela que el desarrollo de estructura es clave para provocar la muerte neuronal.
Es la primera vez que una metodología permite seguir el proceso de agregación y al mismo tiempo detectar que un patrón estructural es responsable de la toxicidad de agrupaciones de beta amiloide.
Los investigadores dicen que estos estudios son un paso adelante para encontrar una diana terapéutica para una enfermedad, hoy por hoy, huérfana de medicamentos.
Metodología presentada
El péptido - proteína pequeña - beta amiloide está fuertemente asociado al Alzheimer pero todavía se busca la prueba inequívoca que lo sitúe como la causa principal del origen y el desarrollo de la enfermedad.
El principal escollo para confirmarlo es que la beta amiloide no hace daño cuando está sola, sino cuando se agrupa consigo misma, hasta que forma las denominadas fibras amiloides.
“No tratamos con una única diana, la beta amiloide, sino que las dianas son múltiples, porque cada agrupación de beta amiloide que se forma durante el proceso de agregación, desde dos unidades hasta 3.000, es una diana potencial. Establecer cual de estas agrupaciones es responsable de la muerte neuronal es un reto complejo y es uno de los puntos críticos para corroborar o refutar la hipótesis beta amiloide”, explica Natàlia Carulla, investigadora del Instituto de Investigación Biomédica (IRB Barcelona), y principal responsable del estudio, en un comunicado de dicho Instituto.
En este trabajo, que publica hoy la revista científica ACS Chemical Biology, Carulla y sus colaboradores presentan la metodología que ha permitido por primera vez distinguir diferentes tipos de agrupaciones de beta amiloide durante el proceso de agregación y, en paralelo, establecer cual de ellas es más tóxica.
El estudio aporta más evidencias hacia la hipótesis de que la muerte de neuronas la provocan los agregados intermedios de beta amiloide y revela que el desarrollo de estructura es clave para provocar la muerte neuronal.
Las formas nocivas de beta amiloide
El trabajo demuestra, por otra parte, que las acumulaciones más tóxicas son las de grupúsculos de entre 20 a 100 unidades de beta amiloide, lo que se conoce como agregados intermedios o agregados precursores de las fibras beta amiloide.
Por contra, para las agrupaciones más pequeñas de beta amiloide, que pueden incluir hasta 3.000 unidades de péptido, los investigadores han detectado prácticamente muerte neuronal.
Para obtener estos resultados, los científicos trataron neuronas de ratón en cultivo con muestras de agregados, obtenidas a diferentes tiempos del proceso de agregación.
El momento en el que observaron máxima mortalidad de neuronas, cercana al 60%, se dio cuando había en el cultivo agregados intermedios de beta amiloide que habían desarrollado un cierto grado de estructura.
El experimento con neuronas de ratón se hizo en colaboración con el laboratorio de Eduardo Soriano de la Universidad de Barcelona, donde se prepararon cultivos de neuronas del hipocampo, el lugar donde primero se observa la pérdida de neuronas en la enfermedad de Alzheimer.
“La técnica que hemos puesto a punto nos permite detectar cómo va incrementando la estructura de estos agregados, o dicho de otra forma, cómo van cogiendo forma, cómo se van ordenando. Y observamos que cuando hay una parte rígida dentro del cúmulo –lo que denominamos estructura- es cuando se da la máxima toxicidad”, detalla Carulla.
Este es precisamente uno de los resultados más esperanzadores de la investigación presentada hoy, señalan los científicos. “La esperanza es que vemos estructura, un orden, un patrón común y si conseguimos ir delimitando con más precisión este patrón estructural seremos capaces de buscar y diseñar moléculas terapéuticas que eviten la formación de agregados o provoquen su rotura”, señala el primer autor del artículo Bernat Serra-Vidal, quien realizó la tesis doctoral con este trabajo.
Además, los investigadores explican que las herramientas para estudiar el proceso de agregación de beta amiloide se podrían aplicar para estudiar el proceso de agregación de otras proteínas que están relacionadas con enfermedades como el Parkinson, la enfermedad de Huntington y la diabetes de tipo 2.
El trabajo demuestra, por otra parte, que las acumulaciones más tóxicas son las de grupúsculos de entre 20 a 100 unidades de beta amiloide, lo que se conoce como agregados intermedios o agregados precursores de las fibras beta amiloide.
Por contra, para las agrupaciones más pequeñas de beta amiloide, que pueden incluir hasta 3.000 unidades de péptido, los investigadores han detectado prácticamente muerte neuronal.
Para obtener estos resultados, los científicos trataron neuronas de ratón en cultivo con muestras de agregados, obtenidas a diferentes tiempos del proceso de agregación.
El momento en el que observaron máxima mortalidad de neuronas, cercana al 60%, se dio cuando había en el cultivo agregados intermedios de beta amiloide que habían desarrollado un cierto grado de estructura.
El experimento con neuronas de ratón se hizo en colaboración con el laboratorio de Eduardo Soriano de la Universidad de Barcelona, donde se prepararon cultivos de neuronas del hipocampo, el lugar donde primero se observa la pérdida de neuronas en la enfermedad de Alzheimer.
“La técnica que hemos puesto a punto nos permite detectar cómo va incrementando la estructura de estos agregados, o dicho de otra forma, cómo van cogiendo forma, cómo se van ordenando. Y observamos que cuando hay una parte rígida dentro del cúmulo –lo que denominamos estructura- es cuando se da la máxima toxicidad”, detalla Carulla.
Este es precisamente uno de los resultados más esperanzadores de la investigación presentada hoy, señalan los científicos. “La esperanza es que vemos estructura, un orden, un patrón común y si conseguimos ir delimitando con más precisión este patrón estructural seremos capaces de buscar y diseñar moléculas terapéuticas que eviten la formación de agregados o provoquen su rotura”, señala el primer autor del artículo Bernat Serra-Vidal, quien realizó la tesis doctoral con este trabajo.
Además, los investigadores explican que las herramientas para estudiar el proceso de agregación de beta amiloide se podrían aplicar para estudiar el proceso de agregación de otras proteínas que están relacionadas con enfermedades como el Parkinson, la enfermedad de Huntington y la diabetes de tipo 2.
Referencia bibliográfica:
Bernat Serra-Vidal, Lluís Pujadas, Daniela Rossi, Eduardo Soriano, Sergio Madurga, Natàlia Carulla. Hydrogen/Deuterium Exchange-Protected Oligomers Populated during Aβ Fibril Formation Correlate with Neuronal Cell Death;. ACS Chem. Biol. (2014). DOI: 10.1021/cb500621x.
Bernat Serra-Vidal, Lluís Pujadas, Daniela Rossi, Eduardo Soriano, Sergio Madurga, Natàlia Carulla. Hydrogen/Deuterium Exchange-Protected Oligomers Populated during Aβ Fibril Formation Correlate with Neuronal Cell Death;. ACS Chem. Biol. (2014). DOI: 10.1021/cb500621x.

 Tendencias Científicas
Tendencias Científicas

 El corazón débil también daña al cerebro
El corazón débil también daña al cerebro CIENCIA ON LINE
CIENCIA ON LINE