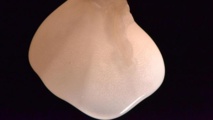
Eliminando todas las células vivas de un riñón de rata queda una estructura de colágeno lista para su repoblación con células de riñón y vasculares. Fuente: MGH.
Científicos del Massachusetts General Hospital (MGH) de Estados Unidos han conseguido desarrollar, gracias a la bioingeniería (rama de la ingeniería que se centra en la biotecnología y en las ciencias biológicas), riñones de rata bioartificiales que produjeron orina tanto en un aparato de laboratorio como al ser implantados en animales vivos.
En un artículo a este respecto, publicado por Nature Medicine, el equipo de investigación ha descrito cómo crearon estos riñones funcionales de reemplazo a partir de células vivas tomadas un riñón de una rata donante. Esta misma técnica había sido previamente utilizada para desarrollar corazones, pulmones e hígados bioartificiales, según informa el MGH a través de Eurekalert.
Lo novedoso de este nuevo avance fue “que la arquitectura del órgano original fue conservada, por lo que se pudo trasplantar el injerto resultante como si fuera del propio donante y conectarlo a los sistemas vascular y urinario del receptor", explica Harald Ott, autor principal del artículo de Nature Medicine e investigador del Centro de medicina regenerativa del MGH.
"Si se pudiera usar esta misma tecnología para producir injertos de tamaño humano, los pacientes que sufren de insuficiencia renal y que actualmente esperan que aparezca un donante o aquellos no aptos para un trasplante, en teoría, podrían recibir órganos nuevos generados a partir de sus propias células”, asegura Ott.
En Estados Unidos, cada año se realizan alrededor de 18.000 trasplantes de riñón, pero 100.000 estadounidenses con enfermedad renal en fase terminal están actualmente a la espera de recibir la donación de un órgano.
Por otro lado, aquellos enfermos que reciben un trasplante han de someterse a fuertes tratamientos inmunosupresores, que plantean muchos riesgos para la salud y que, a pesar de ello, no eliminan por completo el riesgo de rechazo del órgano trasplantado.
En qué consiste
El método utilizado en este estudio para diseñar órganos está basado en una tecnología que Ott descubrió cuando investigaba en la Universidad de Minnesota y que consiste en sustraer las células vivas de un órgano con una solución detergente, para luego repoblar la estructura de colágeno resultante con un tipo de células adecuado.
En este caso, se usaron células endoteliales (que son las que recubren el interior de los vasos sanguíneos y sobre todo de los capilares, formando parte de su pared) humanas para sustituir el recubrimiento del sistema vascular y células de riñón de ratas recién nacidas.
Más concretamente, el equipo de investigación sustrajo en primer lugar las células de los riñones de ratas, para confirmar que las estructuras complejas del órgano se conservaban a pesar de la sustracción. Los científicos comprobaron asimismo que este sistema funcionaba también a mayor escala, al sustraer células de riñones de cerdos y humanos.
Para asegurarse de que las células apropiadas se situaban en las partes correctas de la estructura de colágeno, los investigadores suministraron células vasculares a través de la arteria renal y células de riñón a través del uréter.
Un ajuste preciso de las presiones de las soluciones suministradas permitió activar las células para que estas se dispersasen a través de la totalidad de los órganos, que fueron cultivados durante un máximo de 12 días.
En un artículo a este respecto, publicado por Nature Medicine, el equipo de investigación ha descrito cómo crearon estos riñones funcionales de reemplazo a partir de células vivas tomadas un riñón de una rata donante. Esta misma técnica había sido previamente utilizada para desarrollar corazones, pulmones e hígados bioartificiales, según informa el MGH a través de Eurekalert.
Lo novedoso de este nuevo avance fue “que la arquitectura del órgano original fue conservada, por lo que se pudo trasplantar el injerto resultante como si fuera del propio donante y conectarlo a los sistemas vascular y urinario del receptor", explica Harald Ott, autor principal del artículo de Nature Medicine e investigador del Centro de medicina regenerativa del MGH.
"Si se pudiera usar esta misma tecnología para producir injertos de tamaño humano, los pacientes que sufren de insuficiencia renal y que actualmente esperan que aparezca un donante o aquellos no aptos para un trasplante, en teoría, podrían recibir órganos nuevos generados a partir de sus propias células”, asegura Ott.
En Estados Unidos, cada año se realizan alrededor de 18.000 trasplantes de riñón, pero 100.000 estadounidenses con enfermedad renal en fase terminal están actualmente a la espera de recibir la donación de un órgano.
Por otro lado, aquellos enfermos que reciben un trasplante han de someterse a fuertes tratamientos inmunosupresores, que plantean muchos riesgos para la salud y que, a pesar de ello, no eliminan por completo el riesgo de rechazo del órgano trasplantado.
En qué consiste
El método utilizado en este estudio para diseñar órganos está basado en una tecnología que Ott descubrió cuando investigaba en la Universidad de Minnesota y que consiste en sustraer las células vivas de un órgano con una solución detergente, para luego repoblar la estructura de colágeno resultante con un tipo de células adecuado.
En este caso, se usaron células endoteliales (que son las que recubren el interior de los vasos sanguíneos y sobre todo de los capilares, formando parte de su pared) humanas para sustituir el recubrimiento del sistema vascular y células de riñón de ratas recién nacidas.
Más concretamente, el equipo de investigación sustrajo en primer lugar las células de los riñones de ratas, para confirmar que las estructuras complejas del órgano se conservaban a pesar de la sustracción. Los científicos comprobaron asimismo que este sistema funcionaba también a mayor escala, al sustraer células de riñones de cerdos y humanos.
Para asegurarse de que las células apropiadas se situaban en las partes correctas de la estructura de colágeno, los investigadores suministraron células vasculares a través de la arteria renal y células de riñón a través del uréter.
Un ajuste preciso de las presiones de las soluciones suministradas permitió activar las células para que estas se dispersasen a través de la totalidad de los órganos, que fueron cultivados durante un máximo de 12 días.
Pruebas exitosas
Los investigadores probaron primero los órganos resultantes en un dispositivo que pasa la sangre a través de su sistema vascular y drena la orina, lo que reveló evidencias de filtrado limitado de sangre, de actividad molecular y de producción de orina.
Pero, además, estos riñones de bioingeniería fueron después trasplantados a ratas vivas, a las que se les había quitado un riñón. Estas comenzaron a producir orina tan pronto como el suministro de sangre fue restaurado, sin aparición de hemorragias ni formación de coágulos.
La función general de los órganos regenerados fue significativamente reducida, en comparación con la de riñones normales y saludables, algo que los investigadores achacan a la inmadurez de las células neonatales utilizadas para repoblar la estructura de colágeno. Pero "el perfeccionamiento de los tipos de células utilizadas podría permitirnos desarrollar órganos más eficiente", asegura Ott.
"A partir de los resultados obtenidos, esperamos que los riñones de bioingeniería sirvan algún día para sustituir completamente la función renal, del mismo modo que lo hacen ahora los riñones de donantes. En una futura situación hipotética ideal, los injertos de este tipo podrían llegar a producirse "a la carta", a partir de células del propio paciente, lo que ayudaría a superar tanto la escasez de órganos como la necesidad de inmunosupresión permanente. Estamos investigando métodos para producir tipos más precisos de células y para perfeccionar los métodos de cultivo celular, para crear órganos de tamaño humano”, concluye el investigador.
El equipo de Ott se ha especializado en la regeneración de corazones, pulmones, riñones e injertos formados por tejidos compuestos, mientras que otros equipos - incluyendo uno del Centro de ingeniería médica del MGH- están utilizando esta misma técnica para desarrollar hígados de sustitución.
Los investigadores probaron primero los órganos resultantes en un dispositivo que pasa la sangre a través de su sistema vascular y drena la orina, lo que reveló evidencias de filtrado limitado de sangre, de actividad molecular y de producción de orina.
Pero, además, estos riñones de bioingeniería fueron después trasplantados a ratas vivas, a las que se les había quitado un riñón. Estas comenzaron a producir orina tan pronto como el suministro de sangre fue restaurado, sin aparición de hemorragias ni formación de coágulos.
La función general de los órganos regenerados fue significativamente reducida, en comparación con la de riñones normales y saludables, algo que los investigadores achacan a la inmadurez de las células neonatales utilizadas para repoblar la estructura de colágeno. Pero "el perfeccionamiento de los tipos de células utilizadas podría permitirnos desarrollar órganos más eficiente", asegura Ott.
"A partir de los resultados obtenidos, esperamos que los riñones de bioingeniería sirvan algún día para sustituir completamente la función renal, del mismo modo que lo hacen ahora los riñones de donantes. En una futura situación hipotética ideal, los injertos de este tipo podrían llegar a producirse "a la carta", a partir de células del propio paciente, lo que ayudaría a superar tanto la escasez de órganos como la necesidad de inmunosupresión permanente. Estamos investigando métodos para producir tipos más precisos de células y para perfeccionar los métodos de cultivo celular, para crear órganos de tamaño humano”, concluye el investigador.
El equipo de Ott se ha especializado en la regeneración de corazones, pulmones, riñones e injertos formados por tejidos compuestos, mientras que otros equipos - incluyendo uno del Centro de ingeniería médica del MGH- están utilizando esta misma técnica para desarrollar hígados de sustitución.
Referencia bibliográfica:
Jeremy J Song, Jacques P Guyette, Sarah E Gilpin, Gabriel Gonzalez, Joseph P Vacanti, Harald C Ott. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Medicine (2013). DOI:10.1038/nm.3154.
Jeremy J Song, Jacques P Guyette, Sarah E Gilpin, Gabriel Gonzalez, Joseph P Vacanti, Harald C Ott. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Medicine (2013). DOI:10.1038/nm.3154.

 Tendencias Científicas
Tendencias Científicas

 Nuevo avance permitirá convertir el agua en combustible
Nuevo avance permitirá convertir el agua en combustible CIENCIA ON LINE
CIENCIA ON LINE