Ya se sabe como empieza la vida de cualquier individuo de nuestra especie: a partir de un óvulo fertilizado. Una vez que este ha sido fecundado, se pone en marcha un proceso fundamental, que es la división celular.
De este modo, en un solo día, el óvulo se ha transformado en dos células, en dos días, en cuatro; y así progresivamente hasta dar lugar a los miles de millones de células que conformarán el cuerpo del bebé al nacer.
Por otro lado, cuando los gametos (el óvulo y el espermatozoide) se fusionan durante la fecundación, forman un cigoto (eso que se va dividiendo en más y más células) que tiene 46 cromosomas (la mitad del padre y la otra mitad de la madre). Esos cromosomas contienen los genes o la información genética básica que definirá las características del bebé.
Hasta aquí, el proceso es bien conocido desde hace tiempo. Lo que no ha estado tan claro durante años es cómo se produce la activación genética tras la fecundación. La información es importante, pues de la puesta en marcha secuencial de los genes depende el correcto desarrollo del embrión.
Genes como teclas de encendido
Que sepamos, dos investigaciones han hallado algunas respuestas a esta cuestión en los últimos años. La más reciente la ha aportado un equipo internacional de científicos dirigido desde el Instituto Karolinska de Suecia.
Estos científicos han logrado designar, por vez primera, los genes que se activan en un óvulo humano fertilizado en sus primeros días. Descubrieron en concreto que, de los 23.000 genes humanos que hay, solo 32 se activan dos días después de la fecundación; y que al tercer día de esta ya hay 129 genes activados. Además, han hallado y caracterizado en esta fase del desarrollo de los embriones de nuestra especie siete genes no descubiertos previamente.
Todos los genes encontrados serían como “la ‘tecla’ necesaria para poner en marcha el desarrollo embrionario humano”, explica Juha Kere, profesor del Departamento de Biociencias y Nutrición del Instituto Karolinska y uno de los autores del estudio, en un comunicado de dicho instituto. Otra de las autoras es Outi Hovatta, profesora del Departamento de Ciencia Clínica del mismo centro.
En este desarrollo, hallaron los investigadores además, esos genes pueden interactuar con el llamado “ADN basura” para regular su propia expresión génica (que es el proceso de traducción de la información codificada en el ADN en aquellas proteínas necesarias para la formación y funcionamiento de cualquier organismo).
Así que se ha constatado una vez más que el así llamado ADN basura –considerado hasta hace solo unos años como prescindible, por no ser codificante o no codificar proteínas- en realidad juega un papel fundamental en la regulación de la actividad genética, punto que ya se reveló en un estudio de 2012.
Hovatta y Kere creen que el presente hallazgo, al proporcionar un conocimiento profundo del desarrollo embrionario temprano en humanos, podría ayudar a la creación de nuevas terapias contra la infertilidad o de tratamientos con células madre, para diversas enfermedades.
De este modo, en un solo día, el óvulo se ha transformado en dos células, en dos días, en cuatro; y así progresivamente hasta dar lugar a los miles de millones de células que conformarán el cuerpo del bebé al nacer.
Por otro lado, cuando los gametos (el óvulo y el espermatozoide) se fusionan durante la fecundación, forman un cigoto (eso que se va dividiendo en más y más células) que tiene 46 cromosomas (la mitad del padre y la otra mitad de la madre). Esos cromosomas contienen los genes o la información genética básica que definirá las características del bebé.
Hasta aquí, el proceso es bien conocido desde hace tiempo. Lo que no ha estado tan claro durante años es cómo se produce la activación genética tras la fecundación. La información es importante, pues de la puesta en marcha secuencial de los genes depende el correcto desarrollo del embrión.
Genes como teclas de encendido
Que sepamos, dos investigaciones han hallado algunas respuestas a esta cuestión en los últimos años. La más reciente la ha aportado un equipo internacional de científicos dirigido desde el Instituto Karolinska de Suecia.
Estos científicos han logrado designar, por vez primera, los genes que se activan en un óvulo humano fertilizado en sus primeros días. Descubrieron en concreto que, de los 23.000 genes humanos que hay, solo 32 se activan dos días después de la fecundación; y que al tercer día de esta ya hay 129 genes activados. Además, han hallado y caracterizado en esta fase del desarrollo de los embriones de nuestra especie siete genes no descubiertos previamente.
Todos los genes encontrados serían como “la ‘tecla’ necesaria para poner en marcha el desarrollo embrionario humano”, explica Juha Kere, profesor del Departamento de Biociencias y Nutrición del Instituto Karolinska y uno de los autores del estudio, en un comunicado de dicho instituto. Otra de las autoras es Outi Hovatta, profesora del Departamento de Ciencia Clínica del mismo centro.
En este desarrollo, hallaron los investigadores además, esos genes pueden interactuar con el llamado “ADN basura” para regular su propia expresión génica (que es el proceso de traducción de la información codificada en el ADN en aquellas proteínas necesarias para la formación y funcionamiento de cualquier organismo).
Así que se ha constatado una vez más que el así llamado ADN basura –considerado hasta hace solo unos años como prescindible, por no ser codificante o no codificar proteínas- en realidad juega un papel fundamental en la regulación de la actividad genética, punto que ya se reveló en un estudio de 2012.
Hovatta y Kere creen que el presente hallazgo, al proporcionar un conocimiento profundo del desarrollo embrionario temprano en humanos, podría ayudar a la creación de nuevas terapias contra la infertilidad o de tratamientos con células madre, para diversas enfermedades.
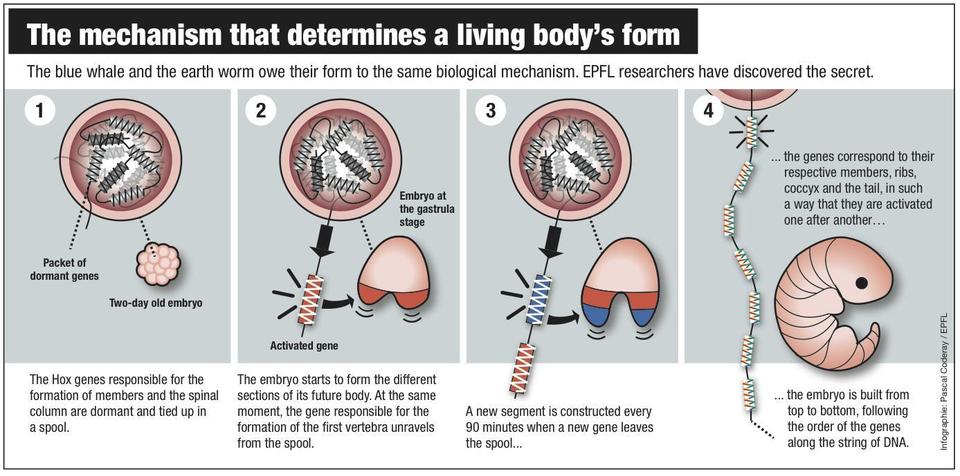
Diagrama del mecanismo de formación embrionaria y la relación de ésta con los genes Hox. Fuente: EPFL.
Cronología y precisión
La segunda investigación a este respecto que hemos mencionado fue realizada en 2011 por científicos de la Escuela Politécnica Federal de Lausanne (EPFL), en Suiza.
Estos investigadores descubrieron en concreto el mecanismo que hace que, al inicio de la formación del embrión (no solo humano, en este caso), los genes se activen siguiendo un orden específico, esto es, el mecanismo por el cual cada parte de un nuevo organismo se va desarrollando donde y cuando debe.
Según los científicos, este mecanismo genético tiene una alta precisión, y en él están implicados unos genes específicos: los genes Hox. Responsables de la formación de las extremidades y de la espina dorsal, estos genes están situados con exactitud unos detrás de otros en la cadena de ADN, formando cuatro grupos. Esta disposición única juega un papel crucial en el proceso de formación fetal.
Los investigadores suizos explicaron entonces que el proceso en realidad es sorprendentemente simple. En los primeros momentos del embrión, los genes Hox están dormidos o inactivos y permanecen enrollados como un carrete de hilo dentro del ADN. Pero, en el momento oportuno, la cadena de ADN comienza a desenrollarse.
Cuando en el embrión se forman los niveles superiores, los genes que codifican la formación de las vértebras cervicales se activan. Lo mismo ocurre con los genes correspondientes al desarrollo de las vértebras torácicas y las del cóccix.
La cadena de ADN actúa, por tanto, enviando instrucciones de forma progresiva.
“Cada noventa minutos sale un nuevo gen de la cadena, lo que se corresponde con el tiempo necesario para que se desarrolle una nueva capa en el embrión. Lleva dos días que la cadena se deshaga completamente: el mismo tiempo que precisa completar todas las capas embrionarias”, detallaron los científicos entonces en la revista Science .
Este sistema descrito ha sido el primer reloj “mecánico” jamás descubierto en genética y ha servido para explicar la exactitud en el desarrollo de los embriones y porqué el desarrollo embrionario es tan sumamente preciso. De hecho, advirtieron los investigadores, el más mínimo fallo en su funcionamiento podría dar lugar incluso a la formación de nuevas especies.
La segunda investigación a este respecto que hemos mencionado fue realizada en 2011 por científicos de la Escuela Politécnica Federal de Lausanne (EPFL), en Suiza.
Estos investigadores descubrieron en concreto el mecanismo que hace que, al inicio de la formación del embrión (no solo humano, en este caso), los genes se activen siguiendo un orden específico, esto es, el mecanismo por el cual cada parte de un nuevo organismo se va desarrollando donde y cuando debe.
Según los científicos, este mecanismo genético tiene una alta precisión, y en él están implicados unos genes específicos: los genes Hox. Responsables de la formación de las extremidades y de la espina dorsal, estos genes están situados con exactitud unos detrás de otros en la cadena de ADN, formando cuatro grupos. Esta disposición única juega un papel crucial en el proceso de formación fetal.
Los investigadores suizos explicaron entonces que el proceso en realidad es sorprendentemente simple. En los primeros momentos del embrión, los genes Hox están dormidos o inactivos y permanecen enrollados como un carrete de hilo dentro del ADN. Pero, en el momento oportuno, la cadena de ADN comienza a desenrollarse.
Cuando en el embrión se forman los niveles superiores, los genes que codifican la formación de las vértebras cervicales se activan. Lo mismo ocurre con los genes correspondientes al desarrollo de las vértebras torácicas y las del cóccix.
La cadena de ADN actúa, por tanto, enviando instrucciones de forma progresiva.
“Cada noventa minutos sale un nuevo gen de la cadena, lo que se corresponde con el tiempo necesario para que se desarrolle una nueva capa en el embrión. Lleva dos días que la cadena se deshaga completamente: el mismo tiempo que precisa completar todas las capas embrionarias”, detallaron los científicos entonces en la revista Science .
Este sistema descrito ha sido el primer reloj “mecánico” jamás descubierto en genética y ha servido para explicar la exactitud en el desarrollo de los embriones y porqué el desarrollo embrionario es tan sumamente preciso. De hecho, advirtieron los investigadores, el más mínimo fallo en su funcionamiento podría dar lugar incluso a la formación de nuevas especies.
Referencia bibliográfica:
Virpi Töhönen, Shintaro Katayama, Liselotte Vesterlund, Eeva-Mari Jouhilahti, Mona Sheikhi, Elo Madissoon, Giuditta Filippini-Cattaneo, Marisa Jaconi, Anna Johnsson, Thomas R. Bürglin, Sten Linnarsson, Outi Hovatta, Juha Kere. Novel PRD-like homeodomain transcription factors and retrotransposon elements in early human development. Nature Communications (2015). DOI: 10.1038/NCOMMS9207.
Virpi Töhönen, Shintaro Katayama, Liselotte Vesterlund, Eeva-Mari Jouhilahti, Mona Sheikhi, Elo Madissoon, Giuditta Filippini-Cattaneo, Marisa Jaconi, Anna Johnsson, Thomas R. Bürglin, Sten Linnarsson, Outi Hovatta, Juha Kere. Novel PRD-like homeodomain transcription factors and retrotransposon elements in early human development. Nature Communications (2015). DOI: 10.1038/NCOMMS9207.

 Tendencias Científicas
Tendencias Científicas



 Los electrones abren un nuevo mundo a la física cuántica
Los electrones abren un nuevo mundo a la física cuántica CIENCIA ON LINE
CIENCIA ON LINE