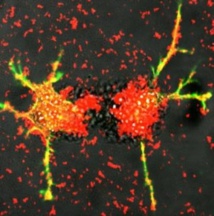
Estos son los glóbulos blancos rediseñados por científicos de la UNC - Chapel Hill. Entrega de exosomas (rojo) las proteínas cargadas que estimulan el crecimiento de las fibras nerviosas dañadas (verde y amarillo). Investigadores de la Facultad de Farmacia Eshelman UNC. Esta técnica se puede desarrollar en un tratamiento potencial para la enfermedad de Parkinson.Fuente: Elena Batrakova / UNC Eshelman Facultad de Farmacia
La enfermedad de Parkinson consiste en un desorden crónico y degenerativo de una de las partes del cerebro que controla el sistema motor. Se manifiesta con una pérdida progresiva de la capacidad de coordinar los movimientos.
Se produce cuando las células nerviosas de la sustancia negra del mesencéfalo, área cerebral que controla el movimiento, mueren o sufren algún deterioro. Esta patología presenta varias características particulares como es el temblor en reposo, lentitud en la iniciación de movimientos y rigidez muscular, entre otros.
El origen de la enfermedad, de momento, es desconocido exceptuando algunos casos inducidos por traumatismos, drogodependencias y medicamentos, además de formas hereditarias en ciertos grupos familiares.
Asimismo, existen numerosas teorías que intentan explicar el deterioro neurológico que produce esta patología. También se cree que algunos pesticidas y toxinas, junto a cierta predisposición genética, podrían ser desencadenantes de esta enfermedad. Otra posible causa podría ser en la existencia de radicales libres, moléculas que desencadenen un proceso de oxidación que daña los tejidos y las neuronas.
Otros de los factores que se tienen en cuenta es la herencia genética. Existen algunas formas de Parkinson hereditarias en algunos grupos de familias, por lo que la investigación genética puede ayudar a entender el desarrollo y funcionamiento de la enfermedad. La causa hereditaria de Parkinson se estima entre un 10 y 15% de los diagnósticos y, en los casos de inicio temprano, alcanza un 50%, según la Fundación Española de Enfermedades Neurológicas (FEEN).
Asimismo, en la enfermedad de Parkinson se produce una degeneración en las células de los ganglios basales que ocasiona una pérdida o una interferencia en la acción de la dopamina y menos conexiones con otras células nerviosas y músculos. La causa de la degeneración de células nerviosas y de la pérdida de dopamina habitualmente no se conoce.
Esta patología afecta por igual a hombre y mujeres de todo el mundo. Su desarrollo está relacionado con la edad, suele aparecer generalmente a partir de los 50 años y la media de inicio de los síntomas se sitúa en los 60. Sin embargo, en los últimos años se ha registrado un aumento considerable de los casos de Parkinson precoz y se estima que cerca del 10 por ciento de los pacientes tienen menos de 40 años.
Se produce cuando las células nerviosas de la sustancia negra del mesencéfalo, área cerebral que controla el movimiento, mueren o sufren algún deterioro. Esta patología presenta varias características particulares como es el temblor en reposo, lentitud en la iniciación de movimientos y rigidez muscular, entre otros.
El origen de la enfermedad, de momento, es desconocido exceptuando algunos casos inducidos por traumatismos, drogodependencias y medicamentos, además de formas hereditarias en ciertos grupos familiares.
Asimismo, existen numerosas teorías que intentan explicar el deterioro neurológico que produce esta patología. También se cree que algunos pesticidas y toxinas, junto a cierta predisposición genética, podrían ser desencadenantes de esta enfermedad. Otra posible causa podría ser en la existencia de radicales libres, moléculas que desencadenen un proceso de oxidación que daña los tejidos y las neuronas.
Otros de los factores que se tienen en cuenta es la herencia genética. Existen algunas formas de Parkinson hereditarias en algunos grupos de familias, por lo que la investigación genética puede ayudar a entender el desarrollo y funcionamiento de la enfermedad. La causa hereditaria de Parkinson se estima entre un 10 y 15% de los diagnósticos y, en los casos de inicio temprano, alcanza un 50%, según la Fundación Española de Enfermedades Neurológicas (FEEN).
Asimismo, en la enfermedad de Parkinson se produce una degeneración en las células de los ganglios basales que ocasiona una pérdida o una interferencia en la acción de la dopamina y menos conexiones con otras células nerviosas y músculos. La causa de la degeneración de células nerviosas y de la pérdida de dopamina habitualmente no se conoce.
Esta patología afecta por igual a hombre y mujeres de todo el mundo. Su desarrollo está relacionado con la edad, suele aparecer generalmente a partir de los 50 años y la media de inicio de los síntomas se sitúa en los 60. Sin embargo, en los últimos años se ha registrado un aumento considerable de los casos de Parkinson precoz y se estima que cerca del 10 por ciento de los pacientes tienen menos de 40 años.
Las células que “curan” neuronas
Ahora, un equipo de investigadores dirigido por Elena Batrakova, profesora asociada de la Escuela Eshelman del Centro de Farmacia de la Nanotecnología en Administración de fármacos de la UNC (EEUU), ha creado unos glóbulos blancos modificados genéticamente -denominados macrófagos- que se encargan de producir el factor neurotrófico derivado de células gliales, o GDNF, y de liberarlo en el cerebro.
En general, las células gliales suministran apoyo y protección a las células nerviosas de todo el cerebro y el cuerpo, y el GDNF puede sanar y estimular el crecimiento de las neuronas dañadas.
"En la actualidad, no existen tratamientos que puedan detener o revertir el curso de la enfermedad de Parkinson. Sólo hay terapias para hacer frente a la calidad de vida, como el reemplazo de la dopamina", dijo Batrakova.
"Sin embargo, los estudios han demostrado que la entrega de factor neurotrófico en el cerebro no sólo promueve la supervivencia de neuronas, sino que también invierte la progresión de la enfermedad de Parkinson", añade la investigadora.
“Enseñando” a las neuronas a curar
Aparte de la entrega de GDNF, los macrófagos modificados pueden “enseñar” a las neuronas a producir la proteína por sí mismas.
Esto tiene lugar gracias a que les proporcionan las herramientas e instrucciones necesarias, como ADN, ARN mensajero o los factores de transcripción. “Si se cumple con éxito el tratamiento en el cerebro, este resultará clave para el éxito de esta terapia de GDNF”, afirma Batrakova.
Además, los macrófagos reutilizados son capaces de penetrar la barrera hematoencefálica, algo que la mayoría de los medicamentos no pueden hacer. Las células reprogramadas viajan al cerebro y producen pequeñas burbujas llamadas exosomas que contienen GDNF.
Estas células liberan los exosomas, que después son capaces de entregar las proteínas a las neuronas en el cerebro. El trabajo se describe en un artículo publicado por la revista Plos One.
"Al enseñar a las células del sistema inmunológico a producir esta proteína protectora, aprovechamos los sistemas naturales del cuerpo para combatir enfermedades degenerativas como la enfermedad de Parkinson", explica Batrakova.
"Esto es un paso sumamente importante hacia una mayor y existosa comercialización de nuestras tecnologías de células, realmente emocionante", señala por su parte Alexander Kabanov, director del centro de nanotecnología. "(...) Muy pronto, creo que vamos a ver estos descubrimientos en la práctica clínica".
Ahora, un equipo de investigadores dirigido por Elena Batrakova, profesora asociada de la Escuela Eshelman del Centro de Farmacia de la Nanotecnología en Administración de fármacos de la UNC (EEUU), ha creado unos glóbulos blancos modificados genéticamente -denominados macrófagos- que se encargan de producir el factor neurotrófico derivado de células gliales, o GDNF, y de liberarlo en el cerebro.
En general, las células gliales suministran apoyo y protección a las células nerviosas de todo el cerebro y el cuerpo, y el GDNF puede sanar y estimular el crecimiento de las neuronas dañadas.
"En la actualidad, no existen tratamientos que puedan detener o revertir el curso de la enfermedad de Parkinson. Sólo hay terapias para hacer frente a la calidad de vida, como el reemplazo de la dopamina", dijo Batrakova.
"Sin embargo, los estudios han demostrado que la entrega de factor neurotrófico en el cerebro no sólo promueve la supervivencia de neuronas, sino que también invierte la progresión de la enfermedad de Parkinson", añade la investigadora.
“Enseñando” a las neuronas a curar
Aparte de la entrega de GDNF, los macrófagos modificados pueden “enseñar” a las neuronas a producir la proteína por sí mismas.
Esto tiene lugar gracias a que les proporcionan las herramientas e instrucciones necesarias, como ADN, ARN mensajero o los factores de transcripción. “Si se cumple con éxito el tratamiento en el cerebro, este resultará clave para el éxito de esta terapia de GDNF”, afirma Batrakova.
Además, los macrófagos reutilizados son capaces de penetrar la barrera hematoencefálica, algo que la mayoría de los medicamentos no pueden hacer. Las células reprogramadas viajan al cerebro y producen pequeñas burbujas llamadas exosomas que contienen GDNF.
Estas células liberan los exosomas, que después son capaces de entregar las proteínas a las neuronas en el cerebro. El trabajo se describe en un artículo publicado por la revista Plos One.
"Al enseñar a las células del sistema inmunológico a producir esta proteína protectora, aprovechamos los sistemas naturales del cuerpo para combatir enfermedades degenerativas como la enfermedad de Parkinson", explica Batrakova.
"Esto es un paso sumamente importante hacia una mayor y existosa comercialización de nuestras tecnologías de células, realmente emocionante", señala por su parte Alexander Kabanov, director del centro de nanotecnología. "(...) Muy pronto, creo que vamos a ver estos descubrimientos en la práctica clínica".
Referencia Bibliográfica:
Yuling Zhao, Matthew J. Haney, Richa Gupta, John P. Bohnsack, Zhijian He, Alexander V. Kabanov, Elena V. Batrakova. GDNF-Transfected Macrophages Produce Potent Neuroprotective Effects in Parkinson's Disease Mouse Model. PLoS ONE (2014). DOI: 10.1371/journal.pone.0106867.

 Tendencias Científicas
Tendencias Científicas

 El corazón débil también daña al cerebro
El corazón débil también daña al cerebro CIENCIA ON LINE
CIENCIA ON LINE