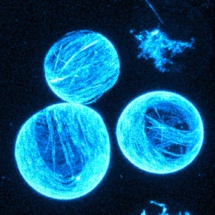
Modelo minimalista artificial de las deformaciones celulares. Imagen: Keber/Loiseau/Sanchez/Bausch. Fuente: TUM.
Utilizando sólo unos pocos ingredientes, el biofísico Andreas Bausch y su equipo de la Universidad Técnica de Múnich (TUM, Alemania) han puesto en marcha con éxito un modelo minimalista de célula que puede cambiar de forma y moverse por sí misma.
Han descrito cómo convirtieron su objetivo en realidad en la última edición de la revista Science, donde su investigación aparece como tema de portada.
Las células son objetos complejos con un sistema metabólico sofisticado. Sus antepasados evolutivos, las células primordiales, estaban compuestos meramente de una membrana y unas pocas moléculas. Se trataba de sistemas minimalistas que sin embargo funcionaban perfectamente.
Por lo tanto, "volver a los orígenes de la célula" se convirtió en la consigna del grupo de Andreas Bausch, que es miembro del clúster de excelencia Iniciativa Nanosistemas Múnich (NIM) y sus socios internacionales. Su sueño es crear un modelo simple de célula con una función específica utilizando algunos ingredientes básicos. En este sentido están siguiendo el principio de la biología sintética, en la que los bloques de construcción celular individuales se ensamblan para crear sistemas biológicos artificiales con nuevas características.
El objetivo de los biofísicos era crear un modelo de tipo celular con una función biomecánica. Debía ser capaz de moverse y cambiar de forma sin influencias externas.
El modelo de los biofísicos incluye una carcasa de membrana, dos tipos diferentes de biomoléculas y algún tipo de combustible. La envoltura, también conocida como vesícula, está hecha de una membrana de lípidos de doble capa, análoga a las membranas celulares naturales. Los científicos llenaron las vesículas con microtúbulos, componentes tubulares del citoesqueleto y kinesinas.
En las células, las kinesinas funcionan normalmente como motores moleculares que transportan los bloques de construcción celular a lo largo de los microtúbulos. En el experimento, estos motores empujan permanentemente los túbulos en paralelo. Para ello, las kinesinas necesitan el portador de energía ATP, que también estaba disponible en la configuración experimental.
Desde un punto de vista físico, los microtúbulos forman un cristal líquido de dos dimensiones debajo de la membrana, que está en un estado permanente de movimiento. "Uno puede imaginarse la capa de cristal líquido como troncos a la deriva en la superficie de un lago", explica Felix Keber, autor principal del estudio, en la nota de prensa de TUM. "Cuando la cosa se pone demasiado congestionada, se alinean en paralelo, pero todavía pueden desplazarse unos junto a otros."
Desperfectos
Para la deformación de la construcción de la célula artificial es decisivo que, incluso en su estado de reposo, el cristal líquido siempre debe contener fallos o desperfectos. Los matemáticos explican este tipo de fenómenos por medio del teorema de Poincaré-Hopf, también conocido como el "problema de la bola peluda." Así como no se puede alisar una bola peluda sin crear un remolino, siempre habrá algunos microtúbulos que no se puedan poner sobre la superficie de la membrana formando un patrón regular.
En ciertos lugares los túbulos se orientarán algo ortogonalmente unos respecto a otros, en una geometría muy específica. Puesto que los microtúbulos, en el caso de la investigación de Múnich, están en constante movimiento unos junto a otrs debido a la actividad de las moléculas de kinesina, los desperfectos también migran. Sorprendentemente, lo hacen de una manera muy uniforme y de manera periódica, oscilando entre dos orientaciones fijas.
Han descrito cómo convirtieron su objetivo en realidad en la última edición de la revista Science, donde su investigación aparece como tema de portada.
Las células son objetos complejos con un sistema metabólico sofisticado. Sus antepasados evolutivos, las células primordiales, estaban compuestos meramente de una membrana y unas pocas moléculas. Se trataba de sistemas minimalistas que sin embargo funcionaban perfectamente.
Por lo tanto, "volver a los orígenes de la célula" se convirtió en la consigna del grupo de Andreas Bausch, que es miembro del clúster de excelencia Iniciativa Nanosistemas Múnich (NIM) y sus socios internacionales. Su sueño es crear un modelo simple de célula con una función específica utilizando algunos ingredientes básicos. En este sentido están siguiendo el principio de la biología sintética, en la que los bloques de construcción celular individuales se ensamblan para crear sistemas biológicos artificiales con nuevas características.
El objetivo de los biofísicos era crear un modelo de tipo celular con una función biomecánica. Debía ser capaz de moverse y cambiar de forma sin influencias externas.
El modelo de los biofísicos incluye una carcasa de membrana, dos tipos diferentes de biomoléculas y algún tipo de combustible. La envoltura, también conocida como vesícula, está hecha de una membrana de lípidos de doble capa, análoga a las membranas celulares naturales. Los científicos llenaron las vesículas con microtúbulos, componentes tubulares del citoesqueleto y kinesinas.
En las células, las kinesinas funcionan normalmente como motores moleculares que transportan los bloques de construcción celular a lo largo de los microtúbulos. En el experimento, estos motores empujan permanentemente los túbulos en paralelo. Para ello, las kinesinas necesitan el portador de energía ATP, que también estaba disponible en la configuración experimental.
Desde un punto de vista físico, los microtúbulos forman un cristal líquido de dos dimensiones debajo de la membrana, que está en un estado permanente de movimiento. "Uno puede imaginarse la capa de cristal líquido como troncos a la deriva en la superficie de un lago", explica Felix Keber, autor principal del estudio, en la nota de prensa de TUM. "Cuando la cosa se pone demasiado congestionada, se alinean en paralelo, pero todavía pueden desplazarse unos junto a otros."
Desperfectos
Para la deformación de la construcción de la célula artificial es decisivo que, incluso en su estado de reposo, el cristal líquido siempre debe contener fallos o desperfectos. Los matemáticos explican este tipo de fenómenos por medio del teorema de Poincaré-Hopf, también conocido como el "problema de la bola peluda." Así como no se puede alisar una bola peluda sin crear un remolino, siempre habrá algunos microtúbulos que no se puedan poner sobre la superficie de la membrana formando un patrón regular.
En ciertos lugares los túbulos se orientarán algo ortogonalmente unos respecto a otros, en una geometría muy específica. Puesto que los microtúbulos, en el caso de la investigación de Múnich, están en constante movimiento unos junto a otrs debido a la actividad de las moléculas de kinesina, los desperfectos también migran. Sorprendentemente, lo hacen de una manera muy uniforme y de manera periódica, oscilando entre dos orientaciones fijas.
Púas
Mientras la vesícula tenga una forma esférica, los fallos no tienen ninguna influencia en la forma externa de la membrana. Sin embargo, tan pronto como se elimina el agua por ósmosis, la vesícula comienza a cambiar de forma debido al movimiento dentro de la membrana.
Como la vesícula pierde cada vez más agua, la flacidez de las formas de membrana se transforma en extensiones con púas como las utilizadas por las células individuales para la locomoción.
En este proceso, una fascinante variedad de formas y dinámicas sale a la luz. Lo que parece aleatorio a primera vista está, de hecho, siguiendo las leyes de la física. Así es como los científicos internacionales lograron descifrar una serie de principios básicos como el comportamiento periódico de las vesículas. Estos principios, a su vez, sirven de base para hacer predicciones en otros sistemas.
"Con nuestro modelo biomolecular sintético hemos creado una nueva opción para el desarrollo de modelos celulares minimalistas", explica Bausch. "Es ideal para el aumento de la complejidad de forma modular con el fin de reconstruir procesos celulares como la migración celular o la división celular de una manera controlada. Que el sistema creado artificialmente pueda describirse exhaustivamente desde una perspectiva física nos da la esperanza de que en los próximos pasos también podremos descubrir los principios básicos que hay detrás de las múltiples deformaciones celulares".
El trabajo de los biofísicos de Múnich se hizo en colaboración con colegas de la Universidad de Brandeis en Waltham (Massachusetts, EE.UU.), la Escuela Internacional de Estudios Avanzados en Trieste (Italia) y la Universidad de Syracuse en Nueva York (EE.UU.).
Mientras la vesícula tenga una forma esférica, los fallos no tienen ninguna influencia en la forma externa de la membrana. Sin embargo, tan pronto como se elimina el agua por ósmosis, la vesícula comienza a cambiar de forma debido al movimiento dentro de la membrana.
Como la vesícula pierde cada vez más agua, la flacidez de las formas de membrana se transforma en extensiones con púas como las utilizadas por las células individuales para la locomoción.
En este proceso, una fascinante variedad de formas y dinámicas sale a la luz. Lo que parece aleatorio a primera vista está, de hecho, siguiendo las leyes de la física. Así es como los científicos internacionales lograron descifrar una serie de principios básicos como el comportamiento periódico de las vesículas. Estos principios, a su vez, sirven de base para hacer predicciones en otros sistemas.
"Con nuestro modelo biomolecular sintético hemos creado una nueva opción para el desarrollo de modelos celulares minimalistas", explica Bausch. "Es ideal para el aumento de la complejidad de forma modular con el fin de reconstruir procesos celulares como la migración celular o la división celular de una manera controlada. Que el sistema creado artificialmente pueda describirse exhaustivamente desde una perspectiva física nos da la esperanza de que en los próximos pasos también podremos descubrir los principios básicos que hay detrás de las múltiples deformaciones celulares".
El trabajo de los biofísicos de Múnich se hizo en colaboración con colegas de la Universidad de Brandeis en Waltham (Massachusetts, EE.UU.), la Escuela Internacional de Estudios Avanzados en Trieste (Italia) y la Universidad de Syracuse en Nueva York (EE.UU.).
Referencia bibliográfica:
Felix C. Keber, Etienne Loiseau, Tim Sanchez, Stephen J. DeCamp, Luca Giomi, Mark J. Bowick, M. Cristina Marchetti, Zvonimir Dogic y Andreas R. Bausch: Topology and dynamics of active nematic vesicles. Science (2014). DOI: 10.1126/science.1254784
Felix C. Keber, Etienne Loiseau, Tim Sanchez, Stephen J. DeCamp, Luca Giomi, Mark J. Bowick, M. Cristina Marchetti, Zvonimir Dogic y Andreas R. Bausch: Topology and dynamics of active nematic vesicles. Science (2014). DOI: 10.1126/science.1254784

 Tendencias Científicas
Tendencias Científicas

 La Inteligencia Artificial puede ver a través del espejo
La Inteligencia Artificial puede ver a través del espejo CIENCIA ON LINE
CIENCIA ON LINE