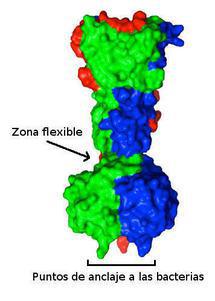
Estructura de las proteínas de anclaje a la pared bacteriana. Imagen: CNB-CSIC.
Cada bacteriófago se adhiere de forma muy específica a una especie concreta de bacteria, por lo que, en principio estos virus nunca podrían usarse de forma generalizada.
Por ello, y como parte de un proyecto financiado por la Fundación Bill & Melinda Gates, en el grupo de Mark van Raaij trabajan sobre la idea de crear mediante mutaciones puntuales una gran variedad de bacteriófagos que puedan ser utilizados contra el tipo de bacteria que se desee.
Su primer paso ha sido estudiar el mecanismo exacto por el que los bacteriófagos se colocan sobre la bacteria y se anclan a su membrana, justo antes de empezar la destrucción de la misma.
Al analizar con precisión la estructura de las fibras mediante las que el bacteriófago T7 se une a las bacterias, Carmela García Doval y Mark van Raaij, investigadores del CNB, han comprobado que están formadas por tres unidades de una misma proteína.
Mediante cristalografía de rayos X, los científicos han determinado la existencia de un área, justo antes de la zona que se une a las bacterias que dota a estas fibras de flexibilidad.
Una flexibilidad que parece ser importante a la hora de que el virus se ancle correctamente sobre la pared bacteriana.
Por ello, y como parte de un proyecto financiado por la Fundación Bill & Melinda Gates, en el grupo de Mark van Raaij trabajan sobre la idea de crear mediante mutaciones puntuales una gran variedad de bacteriófagos que puedan ser utilizados contra el tipo de bacteria que se desee.
Su primer paso ha sido estudiar el mecanismo exacto por el que los bacteriófagos se colocan sobre la bacteria y se anclan a su membrana, justo antes de empezar la destrucción de la misma.
Al analizar con precisión la estructura de las fibras mediante las que el bacteriófago T7 se une a las bacterias, Carmela García Doval y Mark van Raaij, investigadores del CNB, han comprobado que están formadas por tres unidades de una misma proteína.
Mediante cristalografía de rayos X, los científicos han determinado la existencia de un área, justo antes de la zona que se une a las bacterias que dota a estas fibras de flexibilidad.
Una flexibilidad que parece ser importante a la hora de que el virus se ancle correctamente sobre la pared bacteriana.
Pruebas de posibles tratamientos
Gracias a la alta resolución de los datos obtenidos, los científicos han podido localizar con precisión las zonas concretas a través de las cuales se produce la unión entre el fago y la bacteria.
Estos datos corroboran lo que indicaban estudios previos de los aminoácidos que forman estas proteínas.
Ahora, en su laboratorio del CNB, el grupo de van Raaij pretende generar bacteriófagos que contengan mutaciones aleatorias en las zonas que determinan su unión a las bacterias.
Con los miles de mutantes que planean obtener, tendrán que ir analizando la especificidad con la que se unen a las diferentes bacterias.
Una vez que hayan detectado los mutantes que eliminan específicamente a las bacterias patógenas que les interesen, se producirán en grandes cantidades para ensayar su uso como posible tratamiento.
Gracias a la alta resolución de los datos obtenidos, los científicos han podido localizar con precisión las zonas concretas a través de las cuales se produce la unión entre el fago y la bacteria.
Estos datos corroboran lo que indicaban estudios previos de los aminoácidos que forman estas proteínas.
Ahora, en su laboratorio del CNB, el grupo de van Raaij pretende generar bacteriófagos que contengan mutaciones aleatorias en las zonas que determinan su unión a las bacterias.
Con los miles de mutantes que planean obtener, tendrán que ir analizando la especificidad con la que se unen a las diferentes bacterias.
Una vez que hayan detectado los mutantes que eliminan específicamente a las bacterias patógenas que les interesen, se producirán en grandes cantidades para ensayar su uso como posible tratamiento.
Referencia
García-Doval C, van Raaij MJ. Structure of the receptor-binding carboxy-terminal domain of bacteriophage T7 tail fibers. Proc Natl Acad Sci USA. 2012 May 28.
García-Doval C, van Raaij MJ. Structure of the receptor-binding carboxy-terminal domain of bacteriophage T7 tail fibers. Proc Natl Acad Sci USA. 2012 May 28.