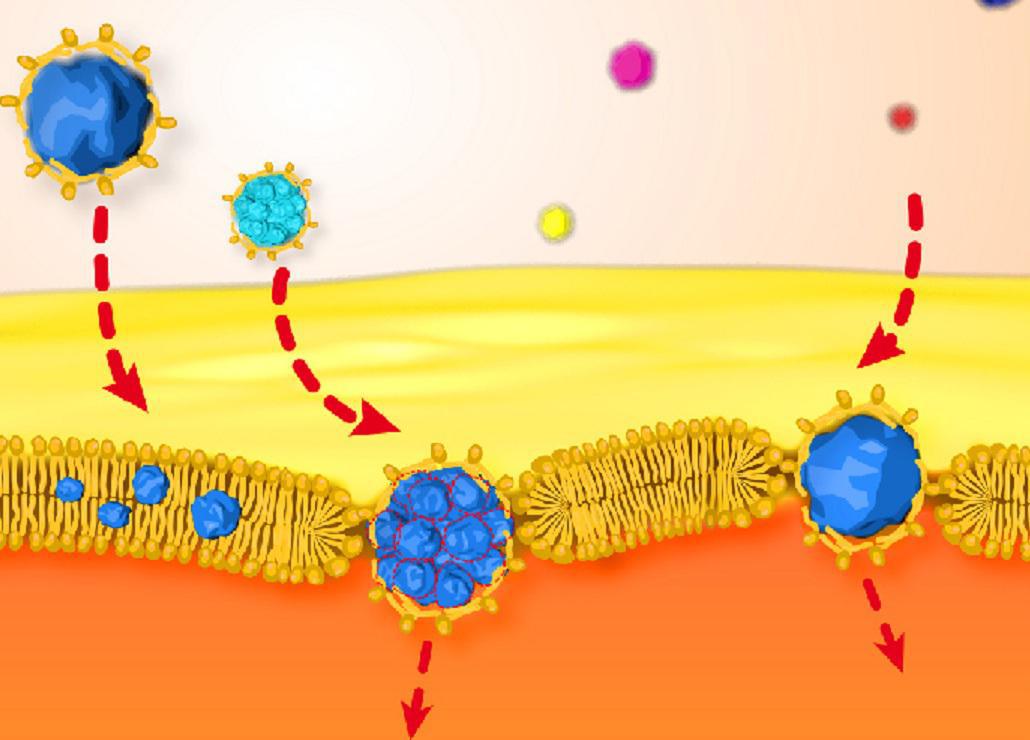
Nanonpartículas de oro hidrófobas recubiertas de lípidos atravesando la membrana. Fuente: URV.
Los nanomateriales forman parte de la mayor parte de los productos que utilizamos en nuestra vida diaria: cosméticos (cremas, dentífricos, champús…), alimentos (azúcar, sal), ropa, edificios de hormigón, pinturas, neumáticos, aceites, productos electrónicos (teléfonos inteligentes, pantallas), productos farmacéuticos (medicamentos, imágenes médicas), etc.
Un reciente informe de la OCDE indica que las nanopartículas están presentes en más de 1.300 productos comerciales. Sin embargo, su toxicidad potencial para las personas, los animales y el medio ambiente se ignora.
La ausencia de instrumentos fiables para monitorizar objetos de escala nano y el elevado número de mecanismos de posible toxicidad conducen a regulaciones controvertidas: por ejemplo, las nanopartículas presentes en las cremas no atraviesan la piel, pero pueden entrar en el cuerpo a través de los pulmones o de las capas mucosas.
Pero la forma en que las nanopartículas interactúan con los tejidos y las barreras humanas, incluidas las membranas celulares, aún no se conoce lo suficiente, entre otras cosas, por la enorme dificultad de visualizar las nanopartículas de forma individual.
De hecho, los nanobjetos se sitúan por debajo del límite de difracción y, por tanto, de la capacidad de los microscopios ópticos. Como consecuencia, se han tenido que diseñar técnicas especiales y originales que faciliten la observación de los acontecimientos en el mundo submicrométrico.
Otra dificultad relacionada con las partículas minúsculas reside en que estas se mueven muy rápido y en que los procesos asociados a ellas duran apenas unas fracciones de segundo; por tanto, las medidas también tienen que ser rápidas.
Un reciente informe de la OCDE indica que las nanopartículas están presentes en más de 1.300 productos comerciales. Sin embargo, su toxicidad potencial para las personas, los animales y el medio ambiente se ignora.
La ausencia de instrumentos fiables para monitorizar objetos de escala nano y el elevado número de mecanismos de posible toxicidad conducen a regulaciones controvertidas: por ejemplo, las nanopartículas presentes en las cremas no atraviesan la piel, pero pueden entrar en el cuerpo a través de los pulmones o de las capas mucosas.
Pero la forma en que las nanopartículas interactúan con los tejidos y las barreras humanas, incluidas las membranas celulares, aún no se conoce lo suficiente, entre otras cosas, por la enorme dificultad de visualizar las nanopartículas de forma individual.
De hecho, los nanobjetos se sitúan por debajo del límite de difracción y, por tanto, de la capacidad de los microscopios ópticos. Como consecuencia, se han tenido que diseñar técnicas especiales y originales que faciliten la observación de los acontecimientos en el mundo submicrométrico.
Otra dificultad relacionada con las partículas minúsculas reside en que estas se mueven muy rápido y en que los procesos asociados a ellas duran apenas unas fracciones de segundo; por tanto, las medidas también tienen que ser rápidas.
Primer hallazgo en simulaciones informáticas
Ahora, un equipo de investigación de física teórica de la Universitat Rovira i Virgili dirigido por el Dr. Vladimir Baulin ha diseñado un proyecto para investigar la interacción entre las nanopartículas y las membranas lipídicas. Baulin forma parte del grupo de investigación “COMPLEX S: Molecular Simulation I: Complex Systems”, del Departamento de Ingeniería Química de la URV, y es coordinador de la Red Europea ITN SNAL,
En simulaciones realizadas por ordenador, los investigadores crearon en primer lugar una “bicapa perfecta”, en la cual todas las colas de lípidos permanecen en su lugar dentro de una membrana.
A partir de sus cálculos, el equipo del Dr. Baulin observó que las pequeñas nanopartículas hidrófobas —que repelen el agua— se pueden insertar en la bicapa lipídica si su tamaño es similar al espesor de la membrana (alrededor de 5 nanómetros). Observaron que estas nanopartículas permanecen atrapadas en la membrana celular, como es comúnmente aceptado por la comunidad científica.
La sorpresa surgió al estudiar el caso de las nanopartículas superhidrófobas: estas no solo se pueden insertar en la membrana de la célula, sino que, además, pueden escapar de ella de forma espontánea, se ha descubierto.
“Es generalmente aceptado que, cuanto más pequeño es un objeto, más facilidad tiene para cruzar barreras. Aquí hemos visto el escenario contrario: nanopartículas de más de 5 nanómetros pueden cruzar la bicapa de manera espontánea”, apunta Baulin.
Prueba de laboratorio
Fue en este punto cuando el equipo de la URV entró en contacto con un equipo de investigación dirigido por el Dr. Jean-Baptiste Fleury, de la Saarland University (Alemania), para confirmar este mecanismo y estudiar experimentalmente este fenómeno único, en que se observa este desplazamiento de la nanopartícula.
Con este propósito, los científicos diseñaron un experimento de microfluidos para formar sistemas bicapa de fosfolípidos, que se pueden considerar membranas de células artificiales. Con esta configuración experimental, exploraron la interacción de las nanopartículas individuales con este tipo de membrana artificial.
Las nanopartículas de oro utilizadas tenían una monocapa de lípidos adsorbidos que garantizaba su dispersión estable y evitaba su agrupación. Utilizando una combinación de microscopia de fluorescencia óptica y mediciones electrofisiológicas, el equipo del Dr. Fleury podría seguir las partículas individuales que cruzan una bicapa y seguir su camino a nivel molecular.
Tal como predecían las simulaciones, se observó que las nanopartículas se insertan en la bicapa mediante la disolución de su recubrimiento de lípidos en la membrana artificial. Las nanopartículas con un diámetro igual o superior a 6 nanómetros (la extensión característica de una bicapa) son capaces de escapar de la bicapa de nuevo en muy pocos milisegundos, mientras que las nanopartículas más pequeñas permanecen atrapadas en el núcleo de la bicapa.
Implicaciones
El descubrimiento del cruce rápido de pequeñas nanopartículas de oro a través de células de barrera protectoras, como la bicapa lipídica, puede plantear problemas de seguridad de los nanomateriales para el público y sugiere la necesidad de revisar las normas de seguridad a escala nanométrica y de llamar la atención sobre la seguridad de los nanomateriales en general.
Ahora, un equipo de investigación de física teórica de la Universitat Rovira i Virgili dirigido por el Dr. Vladimir Baulin ha diseñado un proyecto para investigar la interacción entre las nanopartículas y las membranas lipídicas. Baulin forma parte del grupo de investigación “COMPLEX S: Molecular Simulation I: Complex Systems”, del Departamento de Ingeniería Química de la URV, y es coordinador de la Red Europea ITN SNAL,
En simulaciones realizadas por ordenador, los investigadores crearon en primer lugar una “bicapa perfecta”, en la cual todas las colas de lípidos permanecen en su lugar dentro de una membrana.
A partir de sus cálculos, el equipo del Dr. Baulin observó que las pequeñas nanopartículas hidrófobas —que repelen el agua— se pueden insertar en la bicapa lipídica si su tamaño es similar al espesor de la membrana (alrededor de 5 nanómetros). Observaron que estas nanopartículas permanecen atrapadas en la membrana celular, como es comúnmente aceptado por la comunidad científica.
La sorpresa surgió al estudiar el caso de las nanopartículas superhidrófobas: estas no solo se pueden insertar en la membrana de la célula, sino que, además, pueden escapar de ella de forma espontánea, se ha descubierto.
“Es generalmente aceptado que, cuanto más pequeño es un objeto, más facilidad tiene para cruzar barreras. Aquí hemos visto el escenario contrario: nanopartículas de más de 5 nanómetros pueden cruzar la bicapa de manera espontánea”, apunta Baulin.
Prueba de laboratorio
Fue en este punto cuando el equipo de la URV entró en contacto con un equipo de investigación dirigido por el Dr. Jean-Baptiste Fleury, de la Saarland University (Alemania), para confirmar este mecanismo y estudiar experimentalmente este fenómeno único, en que se observa este desplazamiento de la nanopartícula.
Con este propósito, los científicos diseñaron un experimento de microfluidos para formar sistemas bicapa de fosfolípidos, que se pueden considerar membranas de células artificiales. Con esta configuración experimental, exploraron la interacción de las nanopartículas individuales con este tipo de membrana artificial.
Las nanopartículas de oro utilizadas tenían una monocapa de lípidos adsorbidos que garantizaba su dispersión estable y evitaba su agrupación. Utilizando una combinación de microscopia de fluorescencia óptica y mediciones electrofisiológicas, el equipo del Dr. Fleury podría seguir las partículas individuales que cruzan una bicapa y seguir su camino a nivel molecular.
Tal como predecían las simulaciones, se observó que las nanopartículas se insertan en la bicapa mediante la disolución de su recubrimiento de lípidos en la membrana artificial. Las nanopartículas con un diámetro igual o superior a 6 nanómetros (la extensión característica de una bicapa) son capaces de escapar de la bicapa de nuevo en muy pocos milisegundos, mientras que las nanopartículas más pequeñas permanecen atrapadas en el núcleo de la bicapa.
Implicaciones
El descubrimiento del cruce rápido de pequeñas nanopartículas de oro a través de células de barrera protectoras, como la bicapa lipídica, puede plantear problemas de seguridad de los nanomateriales para el público y sugiere la necesidad de revisar las normas de seguridad a escala nanométrica y de llamar la atención sobre la seguridad de los nanomateriales en general.
Referencia bibliográfica:
Yachong Guo, Emmanuel Terazzi, Ralf Seemann, Jean Baptiste Fleury, Vladimir A. Baulin, Direct proof of spontaneous translocation of lipid-covered hydrophobic nanoparticles through a phospholipid bilayer. Science Advances (2016). DOI: 10.1126/sciadv.1600261.
Yachong Guo, Emmanuel Terazzi, Ralf Seemann, Jean Baptiste Fleury, Vladimir A. Baulin, Direct proof of spontaneous translocation of lipid-covered hydrophobic nanoparticles through a phospholipid bilayer. Science Advances (2016). DOI: 10.1126/sciadv.1600261.