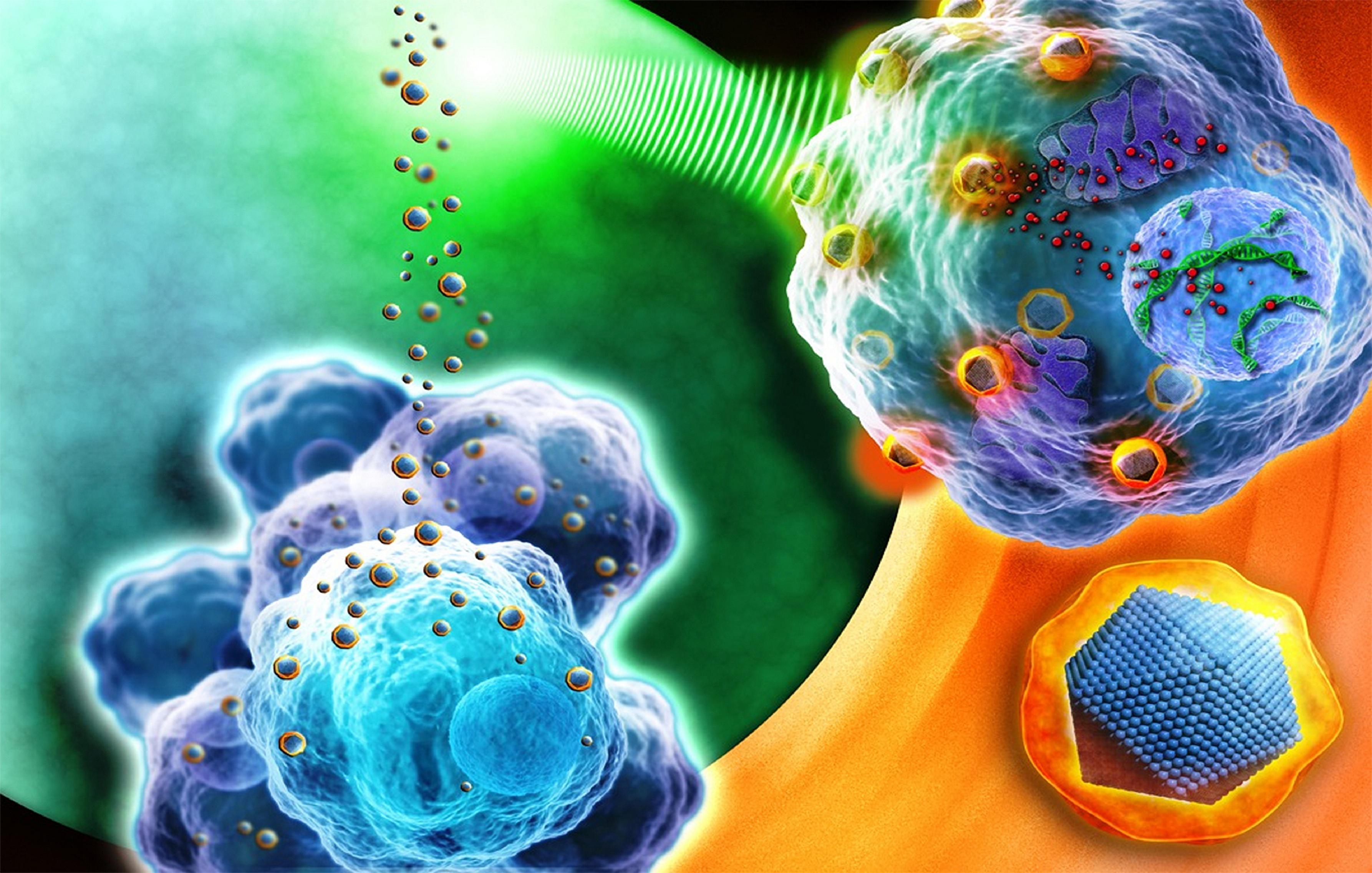
Nanopartículas atacando células tumorales. Fuente: AlphaGalileo.
La palabra cáncer va asociada en muchos casos, afortunadamente, a una lucha y recuperación de dicha enfermedad. A veces porque el diagnóstico se ha realizado a tiempo, otras porque el tratamiento proporcionado ha sido el óptimo para su eliminación.
La comunidad científica es unánime al determinar que el fracaso de la terapia frente al cáncer es una de las principales causas de mortalidad. Poder detectar de forma temprana la efectividad de un tratamiento es, por tanto, vital. Algo que puede tener un efecto significativo en el resultado final de tratamiento y, por tanto, en la calidad de vida del paciente.
Hay que añadir que la respuesta de los tumores a un tratamiento de quimioterapia se determina mediante técnicas de medidas anatómicas directas: tomografía computacional y resonancia magnética, entre otras. El problema es que estas técnicas carecen de sensibilidad o especificidad, de manera que no permiten evaluar la respuesta de una forma temprana. Y estas lecturas no siempre son fiables.
Nanopartículas contra el cáncer
Ahora, un grupo de investigadores de Estados Unidos (Harvard Medical School, Boston) e India (National Chemical Laboratory), ha diseñado nanopartículas que presentan una doble función. Por un lado, aportan el tratamiento quimoterápico o inmunoterápico al tumor y, por otro, aportan información sobre la eficacia del tratamiento a tiempo real.
Estas nanopartículas portan fármacos contra el desarrollo de tumores y, además, se iluminan con luz fluorescente cuando las células cancerígenas empiezan a morir.
Esto permitirá a los médicos monitorizar los efectos del tratamiento del cáncer en un plazo de 8 horas, y poder saber exactamente qué tumores están respondiendo al tratamiento y cuáles no, desde el inicio de dicho tratamiento y sin que haya que esperar un tiempo que puede ser de vital importancia para el paciente.
La comunidad científica es unánime al determinar que el fracaso de la terapia frente al cáncer es una de las principales causas de mortalidad. Poder detectar de forma temprana la efectividad de un tratamiento es, por tanto, vital. Algo que puede tener un efecto significativo en el resultado final de tratamiento y, por tanto, en la calidad de vida del paciente.
Hay que añadir que la respuesta de los tumores a un tratamiento de quimioterapia se determina mediante técnicas de medidas anatómicas directas: tomografía computacional y resonancia magnética, entre otras. El problema es que estas técnicas carecen de sensibilidad o especificidad, de manera que no permiten evaluar la respuesta de una forma temprana. Y estas lecturas no siempre son fiables.
Nanopartículas contra el cáncer
Ahora, un grupo de investigadores de Estados Unidos (Harvard Medical School, Boston) e India (National Chemical Laboratory), ha diseñado nanopartículas que presentan una doble función. Por un lado, aportan el tratamiento quimoterápico o inmunoterápico al tumor y, por otro, aportan información sobre la eficacia del tratamiento a tiempo real.
Estas nanopartículas portan fármacos contra el desarrollo de tumores y, además, se iluminan con luz fluorescente cuando las células cancerígenas empiezan a morir.
Esto permitirá a los médicos monitorizar los efectos del tratamiento del cáncer en un plazo de 8 horas, y poder saber exactamente qué tumores están respondiendo al tratamiento y cuáles no, desde el inicio de dicho tratamiento y sin que haya que esperar un tiempo que puede ser de vital importancia para el paciente.
El uso de nanomateriales en medicina
La ciencia ha mostrado importantes avances en el campo de la nanomedicina en los últimos años. Entre ellos destacan el desarrollo de nanomateriales que se emplean en la administración de fármacos frente a enfermedades como el cáncer, para que el tratamiento resulte más eficaz.
Sin embargo, no existen nanomateriales que combinen una doble función: la de mostrar mediante imágenes la eficacia de un tratamiento determinado y la de ejercer actividad terapéutica. Un sistema dual denominado técnicamente tratanóstico o teranóstico. Las ventajas que ofrece este sistema son, como ya dijimos, la monitorización in vivo.
En base a esto, los investigadores responsables de este estudio han desarrollado una nueva estructura polimérica denominada “nanopartícula reportero” dos en uno, ya que por un lado responde y por otro se estimula.
Esta nanopartícula está constituida por un esqueleto formado por un agente quimioterápico o inmunoterápico citotóxico y un elemento que se activa enzimáticamente, elaborado a partir de un colorante fluorescente. Expliquemos un poco el proceso de funcionamiento de este complejo sistema.
Funcionamiento de las nanopartículas
Cuando se produce la muerte de las células cancerígenas se activa una proteína denominada caspasa. Este fenómeno celular hizo que los investigadores pensaran en incluir, en la nanopartícula, una molécula fluorescente inactiva. De tal manera que, cuando esta nanopartícula está en presencia de la caspasa, la molécula fluorescente se activa.
Estas partículas “reportero” fueron inyectadas en el torrente sanguíneo de ratones enfermos de cáncer. Una vez allí, las nanopartículas comienzan a rodear al tumor e inician la liberación del fármaco. Esto provoca el comienzo de la destrucción de las células cancerígenas y la consiguiente activación de las caspasas. Esta activación, a su vez, produce la iluminación de la molécula fluorescente que brilla bajo la luz infrarroja.
Todo ello permite distinguir entre aquellos tumores que son sensibles al tratamiento y aquellos que son resistentes al mismo, in vivo. Y esto podría saberse en tan solo 8 horas después de dicho tratamiento. Algo que con los métodos actuales (como la exploración de tomografía por emisión de positrones, tomografía computarizada y la resonancia magnética) sólo puede determinarse cuando el paciente ha recibido múltiples ciclos de tratamiento.
Además, las nanopartículas creadas pueden ser empleadas para detectar la inhibición que, en ocasiones, el propio sistema inmune del paciente realiza sobre el tratamiento. En base a ello, las nanopartículas diseñadas tienen capacidad para entregar eficazmente un agente quimioterápico o un inhibidor inmunológico a una célula cancerosa (inhibidor checkpoint).
Inhibidor checkpoint
Una función importante del sistema inmune es su capacidad para diferenciar células normales del organismo de aquellas que son “extrañas”, lo que le permite atacar sólo a éstas últimas.
Para poder hacer esto, el sistema inmune utiliza checkpoints, que son moléculas de ciertas células inmunes que necesitan ser activadas o inactivadas, según el caso, para que se inicie la respuesta inmunitaria.
Las células cancerígenas, en ocasiones, encuentran caminos que utilizan estos checkpoints, lo que les permite evitar ser atacadas por el sistema inmunitario. Así, los fármacos que tienen como objetivo atacar estos checkpoints se consideran una gran promesa para ser empleadosen tratamientos anticancerígenos.
Futuras mejoras
La presente investigación, como vimos antes, ha sido realizada en ratones. Por lo tanto, serán necesarias pruebas de seguridad y eficacia antes de que esta técnica pueda tener aplicabilidad clínica. Pero el hilo conductor ya está establecido, ahora “sólo” será necesario su adaptabilidad al ser humano.
Los siguientes pasos incluyen rediseñar estas nanopartículas empleando materiales y colorantes aprobados clínicamente y que posibiliten un seguimiento fácil. Sin ninguna duda, estos materiales deben de carecer de toxicidad para los humanos.
Aquí es donde radica uno de los principales problemas, pues los colorantes empleados suelen ser tóxicos y deben ser eliminados con rapidez. En cambio, el medicamento necesita un tiempo de actuación. Conjugar estos dos aspectos es sumamente complejo.
Sin embargo, el enfoque de este estudio de poder detectar la presencia o ausencia de eficacia de un fármaco a tiempo real es realmente importante, pues existe la enorme necesidad de personalizar las terapias frente al cáncer para poder ser más eficaces y poder ganar la batalla a este tipo de enfermedad tan dura y cruel.
La ciencia ha mostrado importantes avances en el campo de la nanomedicina en los últimos años. Entre ellos destacan el desarrollo de nanomateriales que se emplean en la administración de fármacos frente a enfermedades como el cáncer, para que el tratamiento resulte más eficaz.
Sin embargo, no existen nanomateriales que combinen una doble función: la de mostrar mediante imágenes la eficacia de un tratamiento determinado y la de ejercer actividad terapéutica. Un sistema dual denominado técnicamente tratanóstico o teranóstico. Las ventajas que ofrece este sistema son, como ya dijimos, la monitorización in vivo.
En base a esto, los investigadores responsables de este estudio han desarrollado una nueva estructura polimérica denominada “nanopartícula reportero” dos en uno, ya que por un lado responde y por otro se estimula.
Esta nanopartícula está constituida por un esqueleto formado por un agente quimioterápico o inmunoterápico citotóxico y un elemento que se activa enzimáticamente, elaborado a partir de un colorante fluorescente. Expliquemos un poco el proceso de funcionamiento de este complejo sistema.
Funcionamiento de las nanopartículas
Cuando se produce la muerte de las células cancerígenas se activa una proteína denominada caspasa. Este fenómeno celular hizo que los investigadores pensaran en incluir, en la nanopartícula, una molécula fluorescente inactiva. De tal manera que, cuando esta nanopartícula está en presencia de la caspasa, la molécula fluorescente se activa.
Estas partículas “reportero” fueron inyectadas en el torrente sanguíneo de ratones enfermos de cáncer. Una vez allí, las nanopartículas comienzan a rodear al tumor e inician la liberación del fármaco. Esto provoca el comienzo de la destrucción de las células cancerígenas y la consiguiente activación de las caspasas. Esta activación, a su vez, produce la iluminación de la molécula fluorescente que brilla bajo la luz infrarroja.
Todo ello permite distinguir entre aquellos tumores que son sensibles al tratamiento y aquellos que son resistentes al mismo, in vivo. Y esto podría saberse en tan solo 8 horas después de dicho tratamiento. Algo que con los métodos actuales (como la exploración de tomografía por emisión de positrones, tomografía computarizada y la resonancia magnética) sólo puede determinarse cuando el paciente ha recibido múltiples ciclos de tratamiento.
Además, las nanopartículas creadas pueden ser empleadas para detectar la inhibición que, en ocasiones, el propio sistema inmune del paciente realiza sobre el tratamiento. En base a ello, las nanopartículas diseñadas tienen capacidad para entregar eficazmente un agente quimioterápico o un inhibidor inmunológico a una célula cancerosa (inhibidor checkpoint).
Inhibidor checkpoint
Una función importante del sistema inmune es su capacidad para diferenciar células normales del organismo de aquellas que son “extrañas”, lo que le permite atacar sólo a éstas últimas.
Para poder hacer esto, el sistema inmune utiliza checkpoints, que son moléculas de ciertas células inmunes que necesitan ser activadas o inactivadas, según el caso, para que se inicie la respuesta inmunitaria.
Las células cancerígenas, en ocasiones, encuentran caminos que utilizan estos checkpoints, lo que les permite evitar ser atacadas por el sistema inmunitario. Así, los fármacos que tienen como objetivo atacar estos checkpoints se consideran una gran promesa para ser empleadosen tratamientos anticancerígenos.
Futuras mejoras
La presente investigación, como vimos antes, ha sido realizada en ratones. Por lo tanto, serán necesarias pruebas de seguridad y eficacia antes de que esta técnica pueda tener aplicabilidad clínica. Pero el hilo conductor ya está establecido, ahora “sólo” será necesario su adaptabilidad al ser humano.
Los siguientes pasos incluyen rediseñar estas nanopartículas empleando materiales y colorantes aprobados clínicamente y que posibiliten un seguimiento fácil. Sin ninguna duda, estos materiales deben de carecer de toxicidad para los humanos.
Aquí es donde radica uno de los principales problemas, pues los colorantes empleados suelen ser tóxicos y deben ser eliminados con rapidez. En cambio, el medicamento necesita un tiempo de actuación. Conjugar estos dos aspectos es sumamente complejo.
Sin embargo, el enfoque de este estudio de poder detectar la presencia o ausencia de eficacia de un fármaco a tiempo real es realmente importante, pues existe la enorme necesidad de personalizar las terapias frente al cáncer para poder ser más eficaces y poder ganar la batalla a este tipo de enfermedad tan dura y cruel.
Referencia bibliográfica:
Kulkarnia A, Raoa P, Natarajana S, Goldmana A, Sabbisettic VS, Khatera Y, Korimerlaa N, Chandrasekara V, Mashelkard RA y Senguptaa S. Reporter nanoparticle that monitors its anticancer efficacy in real time. PNAS (2016). DOI: 10.1073/pnas.1603455113/-/DCSupplemental.
Kulkarnia A, Raoa P, Natarajana S, Goldmana A, Sabbisettic VS, Khatera Y, Korimerlaa N, Chandrasekara V, Mashelkard RA y Senguptaa S. Reporter nanoparticle that monitors its anticancer efficacy in real time. PNAS (2016). DOI: 10.1073/pnas.1603455113/-/DCSupplemental.