Nanopartículas a la búsqueda de tejido tumoral. Fuente: Universidad de Illinois.
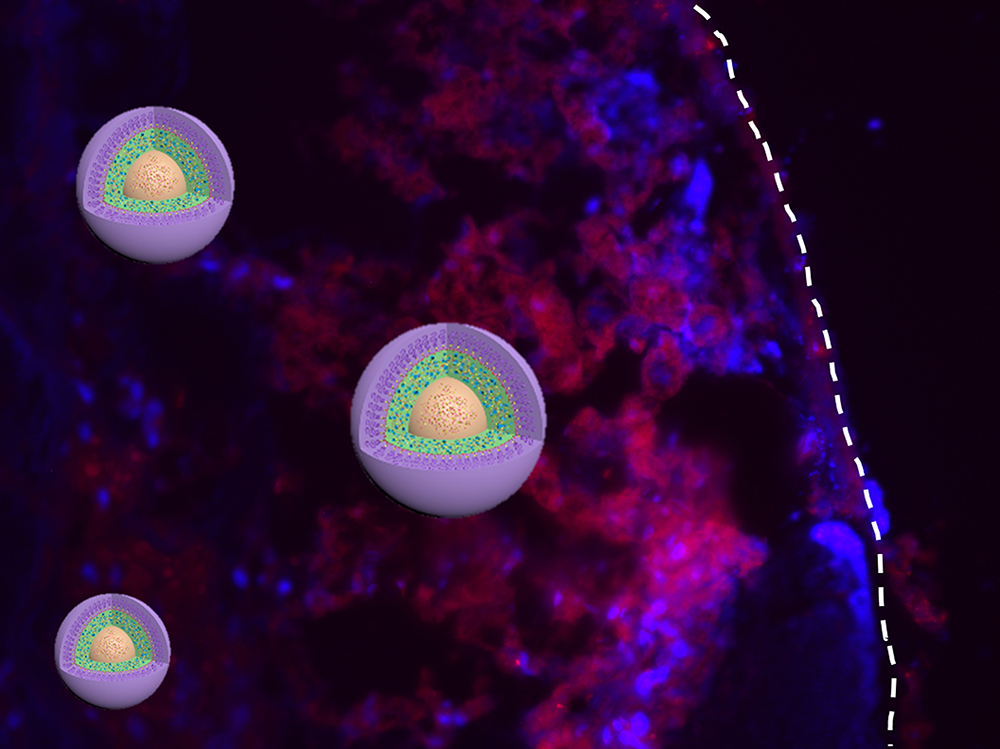
La imposibilidad de los fármacos antitumorales actuales para localizar las células cancerosas y actuar solamente sobre ellas, sin afectar a las sanas, es uno de los principales problemas con los que se encuentran los científicos al abordar el tratamiento del cáncer.
El proyecto de fin de grado de una investigadora de la Universidad Politécnica de Madrid (UPM) pretende modificar la superficie de las nanopartículas (pequeñas estructuras utilizadas para dirigir los fármacos hasta el tumor), de modo que sean más selectivas y ataquen solo a las células cancerosas.
El trabajo, desarrollado por Verónica Rodríguez, actualmente estudiante del Máster de Ingeniería de Materiales de la UPM, ha recibido el Premio Sociemat y Caja de Ingenieros de Madrid al Mejor Proyecto de Fin de Grado en Ingeniería de Materiales.
“Lo que se persigue con el empleo de nanopartículas es dirigir o vectorizar los fármacos hacia el tejido afectado por el tumor, de modo que las células sanas afectadas por el tratamiento, muy agresivo, sean las menos posibles”, explica Rodríguez en la nota de prensa de la UPM. Su trabajo se basa en modificar la estructura externa de estas nanopartículas, conocida como “decoración”, para lograr que se vean más atraídas hacia las células tumorales.
La novedad es la asimetría
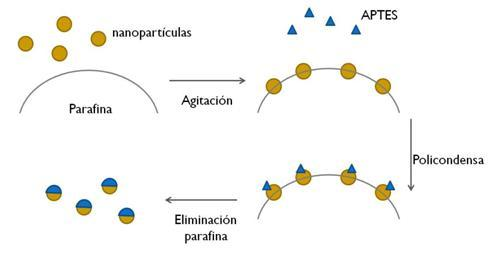
La gran novedad de las moléculas diseñadas en el marco de este proyecto es su asimetría. La mayor parte de las nanopartículas (de forma esférica) están cubiertas por una sola molécula afín al tumor que se desea eliminar, o con varios tipos dispuestos de manera aleatoria. En este caso, la investigadora ha logrado que sean dos moléculas las que estén presentes en la nanopartícula y que lo hagan cubriendo cada una de ellas una parte específica de la esfera.
“La mitad está cubierta por una macromolécula llamada transferrina (proteína transportadora específica del hierro en el plasma) y la otra por ácido fólico, una molécula muy pequeña”, explica Rodríguez. La gran ventaja de esta disposición asimétrica es que permite a los investigadores jugar con moléculas de naturaleza diferente según el tipo de tumor y aumentar la especifidad de las nanopartículas hacia él.
Es la primera vez que se consiguen crear nanopartículas asimétricas y para ello la investigadora ha tenido que llevar a cabo un “procedimiento muy elaborado y novedoso”. Los retos ahora se centran en lograr que las moléculas se distribuyan en las nanopartículas de un modo más uniforme y controlar la cantidad de superficie cubierta por cada molécula, lo que permitirá mejorar la eficacia de las nanopartículas en la lucha contra el cáncer en sus diferentes tipologías.
Verónica Rodríguez ha tenido como tutor principal al catedrático Alejandro Baeza, de la Facultad de Farmacia de la Universidad Complutense de Madrid. Ha desarrollado su proyecto en el Departamento de Química Inorgánica y Bioinorgánica de la Facultad de Farmacia de la UCM, el Centro de Investigación Biomédica en Red: Bioingeniería, Biomateriales y Nanomedicina (CIBER-BBN) y el ICTS Centro Nacional de Microscopia Electrónica.
El proyecto de fin de grado de una investigadora de la Universidad Politécnica de Madrid (UPM) pretende modificar la superficie de las nanopartículas (pequeñas estructuras utilizadas para dirigir los fármacos hasta el tumor), de modo que sean más selectivas y ataquen solo a las células cancerosas.
El trabajo, desarrollado por Verónica Rodríguez, actualmente estudiante del Máster de Ingeniería de Materiales de la UPM, ha recibido el Premio Sociemat y Caja de Ingenieros de Madrid al Mejor Proyecto de Fin de Grado en Ingeniería de Materiales.
“Lo que se persigue con el empleo de nanopartículas es dirigir o vectorizar los fármacos hacia el tejido afectado por el tumor, de modo que las células sanas afectadas por el tratamiento, muy agresivo, sean las menos posibles”, explica Rodríguez en la nota de prensa de la UPM. Su trabajo se basa en modificar la estructura externa de estas nanopartículas, conocida como “decoración”, para lograr que se vean más atraídas hacia las células tumorales.
La novedad es la asimetría
La gran novedad de las moléculas diseñadas en el marco de este proyecto es su asimetría. La mayor parte de las nanopartículas (de forma esférica) están cubiertas por una sola molécula afín al tumor que se desea eliminar, o con varios tipos dispuestos de manera aleatoria. En este caso, la investigadora ha logrado que sean dos moléculas las que estén presentes en la nanopartícula y que lo hagan cubriendo cada una de ellas una parte específica de la esfera.
“La mitad está cubierta por una macromolécula llamada transferrina (proteína transportadora específica del hierro en el plasma) y la otra por ácido fólico, una molécula muy pequeña”, explica Rodríguez. La gran ventaja de esta disposición asimétrica es que permite a los investigadores jugar con moléculas de naturaleza diferente según el tipo de tumor y aumentar la especifidad de las nanopartículas hacia él.
Es la primera vez que se consiguen crear nanopartículas asimétricas y para ello la investigadora ha tenido que llevar a cabo un “procedimiento muy elaborado y novedoso”. Los retos ahora se centran en lograr que las moléculas se distribuyan en las nanopartículas de un modo más uniforme y controlar la cantidad de superficie cubierta por cada molécula, lo que permitirá mejorar la eficacia de las nanopartículas en la lucha contra el cáncer en sus diferentes tipologías.
Verónica Rodríguez ha tenido como tutor principal al catedrático Alejandro Baeza, de la Facultad de Farmacia de la Universidad Complutense de Madrid. Ha desarrollado su proyecto en el Departamento de Química Inorgánica y Bioinorgánica de la Facultad de Farmacia de la UCM, el Centro de Investigación Biomédica en Red: Bioingeniería, Biomateriales y Nanomedicina (CIBER-BBN) y el ICTS Centro Nacional de Microscopia Electrónica.
Esquema del proceso de asimetrización de las partículas. Fuente: UPM.
El tamaño ideal
Otras investigaciones previas ya han observado indicios de la utilidad de las nanopartículas contra el cáncer. Un equipo de científicos de la Universidad de Georgia (EE.UU.) las utilizaron, junto con campos magnéticos alternantes, para atacar las células cancerígenas de los tumores de cuello y cabeza de ratones. Los resultados obtenidos revelaron que se podían matar las células cancerígenas en tan sólo media hora, sin que resultaran dañadas las células sanas cercanas.
Un estudio realizado por investigadores de la Universidad de Illinois (EE.UU.) parece haber revelado el “tamaño ideal” de las nanopartículas para el tratamiento del cáncer. La investigación consistió en evaluar sistemáticamente los perfiles biológicos dependientes del tamaño de tres nanoconjugados de partículas de sílice monodispersas (de 20, 50 y 200 nanómetros –un nanómetros equivale a una mil millonésima parte de un metro-).
Los resultados obtenidos revelaron que, entre estos tres nanoconjugados, aquellos con partículas de un tamaño de 50 nm fueron los más eficientes en penetración profunda en el tejido tumoral y en internalización en células cancerígenas (donde se liberarían los medicamentos que portan las nanopartículas); así como en eliminación de tumores en vivo, tanto primarios como metastásicos, de diversa índole.
Las nanopartículas también sirven para detectar los tumores. Investigadores de la Universidad de Stanford y del Hospital Infantil Lucile Packard de Stanford (EE.UU.) han desarrollado un método de examen sin radiación de pacientes jóvenes con cáncer. Se trata de una variación de la resonancia magnética, que utiliza un nuevo medio de contraste constituido por nanopartículas de hierro.
Estas nanopartículas son retenidas por el cuerpo durante muchos días. En las resonancias magnéticas, hacen que los vasos sanguíneos aparezcan más brillantes, proporcionando puntos anatómicos de referencia. Las nanopartículas también hacen que la médula ósea sana, los ganglios linfáticos, el hígado y el bazo tengan un aspecto más oscuro, destacando los tumores.
Otras investigaciones previas ya han observado indicios de la utilidad de las nanopartículas contra el cáncer. Un equipo de científicos de la Universidad de Georgia (EE.UU.) las utilizaron, junto con campos magnéticos alternantes, para atacar las células cancerígenas de los tumores de cuello y cabeza de ratones. Los resultados obtenidos revelaron que se podían matar las células cancerígenas en tan sólo media hora, sin que resultaran dañadas las células sanas cercanas.
Un estudio realizado por investigadores de la Universidad de Illinois (EE.UU.) parece haber revelado el “tamaño ideal” de las nanopartículas para el tratamiento del cáncer. La investigación consistió en evaluar sistemáticamente los perfiles biológicos dependientes del tamaño de tres nanoconjugados de partículas de sílice monodispersas (de 20, 50 y 200 nanómetros –un nanómetros equivale a una mil millonésima parte de un metro-).
Los resultados obtenidos revelaron que, entre estos tres nanoconjugados, aquellos con partículas de un tamaño de 50 nm fueron los más eficientes en penetración profunda en el tejido tumoral y en internalización en células cancerígenas (donde se liberarían los medicamentos que portan las nanopartículas); así como en eliminación de tumores en vivo, tanto primarios como metastásicos, de diversa índole.
Las nanopartículas también sirven para detectar los tumores. Investigadores de la Universidad de Stanford y del Hospital Infantil Lucile Packard de Stanford (EE.UU.) han desarrollado un método de examen sin radiación de pacientes jóvenes con cáncer. Se trata de una variación de la resonancia magnética, que utiliza un nuevo medio de contraste constituido por nanopartículas de hierro.
Estas nanopartículas son retenidas por el cuerpo durante muchos días. En las resonancias magnéticas, hacen que los vasos sanguíneos aparezcan más brillantes, proporcionando puntos anatómicos de referencia. Las nanopartículas también hacen que la médula ósea sana, los ganglios linfáticos, el hígado y el bazo tengan un aspecto más oscuro, destacando los tumores.