La nanomedicina (en rojo) con el tamaño óptimo muestra una retención del tejido tumoral más alta (en azul). Fuente: Universidad de Illinois.
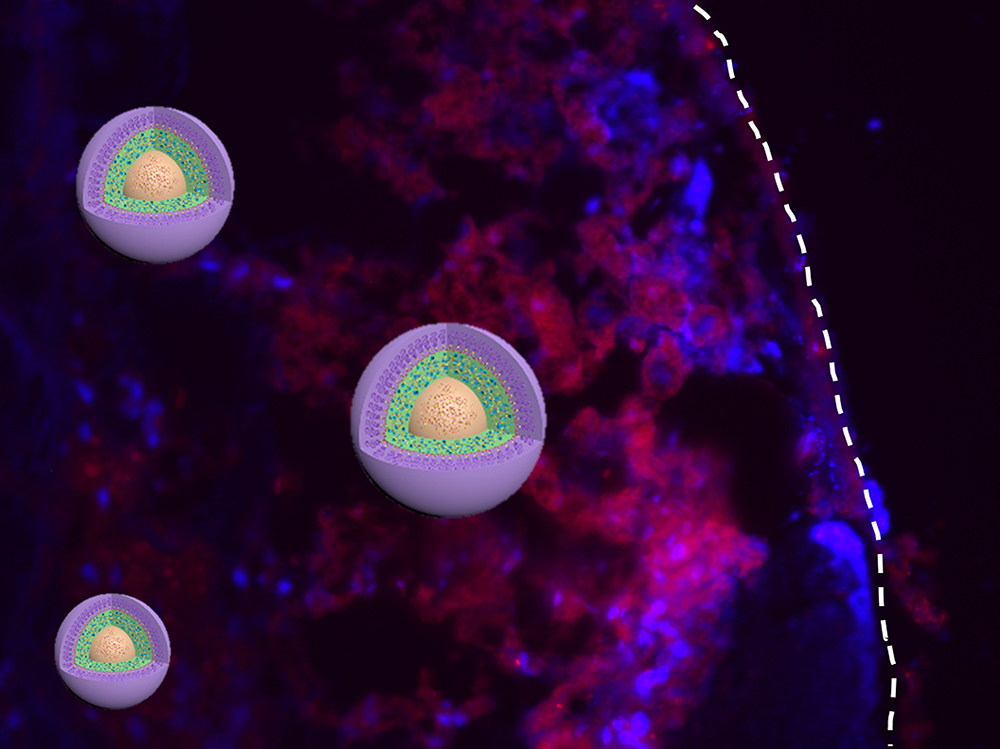
Las nanomedicinas consisten en nanopartículas (partículas de un tamaño tan minúsculo que solo se pueden ver con microscopio) capaces de administrar fármacos a células y tejidos específicos, de manera dirigida.
De ellas, entre otros temas, se está hablando estos días en Madrid, en el marco del Simposio Internacional de Terapias oncológicas avanzadas que, organizado por la Fundación Ramón Areces y la Real Academia Nacional de Farmacia, ha reunido a numerosos oncólogos.
Algunos de estos expertos, como el español José Baselga, director médico del Memorial Sloan-Kettering Cancer Center de Nueva York y uno de los mayores expertos en cáncer de mama, trabajan en la creación de este tipo de medicamentos minúsculos, en concreto para el tratamiento del cáncer. Y es que, en este campo, las nanopartículas pueden ofrecer múltiples opciones, tanto para el diagnóstico como para el tratamiento de la enfermedad.
Pero antes de usarlas de la manera más eficiente y segura, hay que comprender bien un factor fundamental: la interrelación entre las propiedades fisicoquímicas de los nanomedicamentos y las funciones biológicas del organismo. Más concretamente, qué tamaño de nanopartícula es el más eficiente para provocar ciertas respuestas orgánicas.
De ellas, entre otros temas, se está hablando estos días en Madrid, en el marco del Simposio Internacional de Terapias oncológicas avanzadas que, organizado por la Fundación Ramón Areces y la Real Academia Nacional de Farmacia, ha reunido a numerosos oncólogos.
Algunos de estos expertos, como el español José Baselga, director médico del Memorial Sloan-Kettering Cancer Center de Nueva York y uno de los mayores expertos en cáncer de mama, trabajan en la creación de este tipo de medicamentos minúsculos, en concreto para el tratamiento del cáncer. Y es que, en este campo, las nanopartículas pueden ofrecer múltiples opciones, tanto para el diagnóstico como para el tratamiento de la enfermedad.
Pero antes de usarlas de la manera más eficiente y segura, hay que comprender bien un factor fundamental: la interrelación entre las propiedades fisicoquímicas de los nanomedicamentos y las funciones biológicas del organismo. Más concretamente, qué tamaño de nanopartícula es el más eficiente para provocar ciertas respuestas orgánicas.
El “tamaño ideal”
Un estudio realizado por investigadores de la Universidad de Illinois (que no participan en el simposio mencionado) parece haber revelado el “tamaño ideal” de dichas nanopartículas para el tratamiento del cáncer.
Realizado por Jianjun Cheng, profesor asociado de ciencias de los materiales e ingeniería en la Universidad de Illinois en Urbana-Champaign, y sus colaboradores, la investigación consistió en evaluar sistemáticamente los perfiles biológicos dependientes del tamaño de tres nanoconjugados de partículas de sílice monodispersas (de 20, 50 y 200 nanómetros –un nanómetros equivale a una mil millonésima parte de un metro-), informa dicha Universidad en un comunicado.
Los resultados obtenidos revelaron que, entre estos tres nanoconjugados, aquellos con partículas de un tamaño de 50 nm fueron los más eficientes en penetración profunda en el tejido tumoral y en internalización en células cancerígenas (donde se liberarían los medicamentos que portan las nanopartículas); así como en eliminación de tumores en vivo, tanto primarios como metastásicos, de diversa índole.
"En las últimos dos o tres décadas, se ha llegado al consenso de que el tamaño de la partícula juega un papel fundamental en la determinación de su biodistribución, en la penetración en el tumor y en la internalización celular; pero también en la eliminación del plasma de la sangre y de los tejidos y la excreción del cuerpo, todo lo cual impacta en la eficacia terapéutica global contra el cáncer", explica al respecto Li Tang, otro de los autores del estudio.
"Nuestros análisis muestran evidencias claras de que existe un tamaño de partícula óptimo para los nanomedicamentos contra el cáncer, que resulta en una mayor retención de los tumores”, asegura el científico.
Para la investigación, Cheng y su equipo desarrollaron un modelo matemático de la distribución espaciotemporal de las nanopartículas dentro de un tumor esféricamente simétrico. Según ellos, los resultados obtenidos son de extremada importancia para guiar la investigación futura en el diseño de nuevos nanomedicamentos para el tratamiento del cáncer.
En cinco o diez años: nanodiagnóstico y nanotratamiento
Volviendo al Simposio Internacional 'Terapias oncológicas avanzadas' de Madrid, uno de sus invitados ha sido Robert S. Langer, profesor en el David H. Koch Institute del MIT de Cambridge.
Considerado el padre de la liberación inteligente de fármacos por el desarrollo de novedosos materiales en forma de polímeros, nanopartículas o chips, que posibilitan la distribución controlada de fármacos por el cuerpo, en la actualidad, Langer trabaja en colaboración con el equipo de José Baselga en el desarrollo de una nanopartícula de ocho micras (una micra es equivalente a una millonésima parte de un metro e igual a 1.000 nm) que posee entre 30 y 50 pocillos, en los que se puede poner la medicación que se quiera suministrar directamente en el tumor.
Asimismo, esta nanopartícula se podría introducir en una biopsia normal, extraerse y, al día siguiente, con la información obtenida de ella, decidir qué tratamiento va a funcionar mejor para el tumor analizado. Según Langer, algunos de estos nuevos medicamentos podrán verse en cinco o 10 años.
Por otra parte, Langer también está desarrollando microchips de liberación controlada, en los que se puede introducir un solo fármaco o una combinación de varios y liberar una determinada cantidad en un lugar concreto, gracias a un programa de ordenador o control remoto, ha informado la plataforma Sinc.
Un estudio realizado por investigadores de la Universidad de Illinois (que no participan en el simposio mencionado) parece haber revelado el “tamaño ideal” de dichas nanopartículas para el tratamiento del cáncer.
Realizado por Jianjun Cheng, profesor asociado de ciencias de los materiales e ingeniería en la Universidad de Illinois en Urbana-Champaign, y sus colaboradores, la investigación consistió en evaluar sistemáticamente los perfiles biológicos dependientes del tamaño de tres nanoconjugados de partículas de sílice monodispersas (de 20, 50 y 200 nanómetros –un nanómetros equivale a una mil millonésima parte de un metro-), informa dicha Universidad en un comunicado.
Los resultados obtenidos revelaron que, entre estos tres nanoconjugados, aquellos con partículas de un tamaño de 50 nm fueron los más eficientes en penetración profunda en el tejido tumoral y en internalización en células cancerígenas (donde se liberarían los medicamentos que portan las nanopartículas); así como en eliminación de tumores en vivo, tanto primarios como metastásicos, de diversa índole.
"En las últimos dos o tres décadas, se ha llegado al consenso de que el tamaño de la partícula juega un papel fundamental en la determinación de su biodistribución, en la penetración en el tumor y en la internalización celular; pero también en la eliminación del plasma de la sangre y de los tejidos y la excreción del cuerpo, todo lo cual impacta en la eficacia terapéutica global contra el cáncer", explica al respecto Li Tang, otro de los autores del estudio.
"Nuestros análisis muestran evidencias claras de que existe un tamaño de partícula óptimo para los nanomedicamentos contra el cáncer, que resulta en una mayor retención de los tumores”, asegura el científico.
Para la investigación, Cheng y su equipo desarrollaron un modelo matemático de la distribución espaciotemporal de las nanopartículas dentro de un tumor esféricamente simétrico. Según ellos, los resultados obtenidos son de extremada importancia para guiar la investigación futura en el diseño de nuevos nanomedicamentos para el tratamiento del cáncer.
En cinco o diez años: nanodiagnóstico y nanotratamiento
Volviendo al Simposio Internacional 'Terapias oncológicas avanzadas' de Madrid, uno de sus invitados ha sido Robert S. Langer, profesor en el David H. Koch Institute del MIT de Cambridge.
Considerado el padre de la liberación inteligente de fármacos por el desarrollo de novedosos materiales en forma de polímeros, nanopartículas o chips, que posibilitan la distribución controlada de fármacos por el cuerpo, en la actualidad, Langer trabaja en colaboración con el equipo de José Baselga en el desarrollo de una nanopartícula de ocho micras (una micra es equivalente a una millonésima parte de un metro e igual a 1.000 nm) que posee entre 30 y 50 pocillos, en los que se puede poner la medicación que se quiera suministrar directamente en el tumor.
Asimismo, esta nanopartícula se podría introducir en una biopsia normal, extraerse y, al día siguiente, con la información obtenida de ella, decidir qué tratamiento va a funcionar mejor para el tumor analizado. Según Langer, algunos de estos nuevos medicamentos podrán verse en cinco o 10 años.
Por otra parte, Langer también está desarrollando microchips de liberación controlada, en los que se puede introducir un solo fármaco o una combinación de varios y liberar una determinada cantidad en un lugar concreto, gracias a un programa de ordenador o control remoto, ha informado la plataforma Sinc.
Referencia bibliográfica:
Li Tang, Jianjun Cheng, et al. Investigating the optimal size of anticancer nanomedicine. Proceedings of the National Academy of Sciences (2014). DOI: 10.1073/pnas.1411499111.
Li Tang, Jianjun Cheng, et al. Investigating the optimal size of anticancer nanomedicine. Proceedings of the National Academy of Sciences (2014). DOI: 10.1073/pnas.1411499111.