En rojo, el “ataúd” formado para proteger la membrana celular. Fuente: UPO.
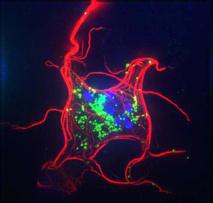
Existe vida tras la muerte celular, o al menos una zona libre de muerte durante la apoptosis (forma de muerte celular que está desencadenada por señales celulares controladas genéticamente).
Así lo ha demostrado un estudio pionero liderado por José Antonio Sánchez Alcazar, investigador de la Universidad Pablo de Olavide (UPO), de Sevilla, que supone un cambio conceptual en el proceso natural de muerte celular.
Los resultados del trabajo, publicados por la revista Cell Death and Disease, demuestran por primera vez cómo el córtex celular mantiene su integridad, mientras el resto de la célula está siendo “degradado” por un grupo de proteínas conocidas como caspasas, que son .
El hallazgo aporta nuevos conocimientos sobre esta materia, con posibles aplicaciones médicas en áreas como el tratamiento del cáncer, informa la UPO en un comunicado.
Tipos de muerte celular
En torno a 3.000.000 de células mueren cada segundo en el organismo humano de manera natural. En su mayoría lo hacen por apoptosis, es decir, degradándose sin liberar su contenido al exterior celular a la espera de ser comidas por células vecinas o por células especializadas como los macrófagos.
Por el contrario, ante una quemadura o un golpe, se produce el proceso antitético: la necrosis, en la que el contenido celular se disemina. “Si la célula fuese una uva, estaríamos comparando una pasa, que se va consumiendo por dentro, con otra uva que explota producto de un martillazo”, señala Sánchez Alcázar.
Una diferencia importante ya que, como apunta este investigador, la necrosis trae consecuencias para el organismo, como efectos tóxicos a las células vecinas y una reacción inflamatoria en su entorno.
“La muerte por apoptosis es similar a una implosión. La célula es como una carpa de circo, está llena de vigas que componen el citoesqueleto, con microtúbulos, filamentos intermedios, filamentos de actina… Cuando éstos últimos se contraen al comienzo de la apoptosis, el resto de elementos se despolimerizan y la célula se queda sin sostén, la carpa se viene abajo”, afirma el responsable del trabajo.
Las caspasas, proteínas encargadas de degradar el interior celular, juegan además un papel importante en este proceso. Sin embargo, su acción pone en peligro la integridad de la membrana plasmática.
Si llegaran a degradarla, interrumpiendo la actividad de las proteínas ligadas a ella, se produciría una necrosis y la liberación de los componentes tóxicos intracelulares.
Así lo ha demostrado un estudio pionero liderado por José Antonio Sánchez Alcazar, investigador de la Universidad Pablo de Olavide (UPO), de Sevilla, que supone un cambio conceptual en el proceso natural de muerte celular.
Los resultados del trabajo, publicados por la revista Cell Death and Disease, demuestran por primera vez cómo el córtex celular mantiene su integridad, mientras el resto de la célula está siendo “degradado” por un grupo de proteínas conocidas como caspasas, que son .
El hallazgo aporta nuevos conocimientos sobre esta materia, con posibles aplicaciones médicas en áreas como el tratamiento del cáncer, informa la UPO en un comunicado.
Tipos de muerte celular
En torno a 3.000.000 de células mueren cada segundo en el organismo humano de manera natural. En su mayoría lo hacen por apoptosis, es decir, degradándose sin liberar su contenido al exterior celular a la espera de ser comidas por células vecinas o por células especializadas como los macrófagos.
Por el contrario, ante una quemadura o un golpe, se produce el proceso antitético: la necrosis, en la que el contenido celular se disemina. “Si la célula fuese una uva, estaríamos comparando una pasa, que se va consumiendo por dentro, con otra uva que explota producto de un martillazo”, señala Sánchez Alcázar.
Una diferencia importante ya que, como apunta este investigador, la necrosis trae consecuencias para el organismo, como efectos tóxicos a las células vecinas y una reacción inflamatoria en su entorno.
“La muerte por apoptosis es similar a una implosión. La célula es como una carpa de circo, está llena de vigas que componen el citoesqueleto, con microtúbulos, filamentos intermedios, filamentos de actina… Cuando éstos últimos se contraen al comienzo de la apoptosis, el resto de elementos se despolimerizan y la célula se queda sin sostén, la carpa se viene abajo”, afirma el responsable del trabajo.
Las caspasas, proteínas encargadas de degradar el interior celular, juegan además un papel importante en este proceso. Sin embargo, su acción pone en peligro la integridad de la membrana plasmática.
Si llegaran a degradarla, interrumpiendo la actividad de las proteínas ligadas a ella, se produciría una necrosis y la liberación de los componentes tóxicos intracelulares.
Ataúd celular
Es por ello que la célula, según un trabajo previo de estos investigadores, desarrolla lo que se ha bautizado como el “ataúd celular”.
Una pared de microtúbulos, que se crea en el córtex celular, sosteniendo y protegiendo a la membrana de las células de la acción de las caspasas.
“Mientras dura el ataúd, las células apoptóticas mantienen su contenido que está siendo degradado dentro de las células, el tiempo suficiente para que otra célula vecina o un macrófago se la coma”, apunta Sánchez Alcázar.
Pero para que esto sea posible, como demuestran en este nuevo estudio, lo que hay entre la nueva pared de microtúbulos y la membrana debe permanecer vivo y funcionando con normalidad. “Es vida después de la muerte”, subraya este investigador.
En concreto, los científicos de la Universidad Pablo de Olavide han constatado en cultivos celulares que, gracias a este ataúd, el córtex celular se mantiene vivo.
Un trabajo en el que se ha comprobado la integridad de todas las proteínas que lo integran (las de sostén y adhesión celular, las reguladoras del calcio y el sodio…).
Una situación que permite, entre otras cosas, describir la hipótesis de la “fresh meat”, o carne fresca. Es decir, “gracias a este proceso, las otras células reconocen que las células apoptóticas han muerto recientemente y se encuentran en buen estado, la ven como un bocado apetitoso y se la comen, pudiendo ser reemplazada por otra en su lugar”, apunta Sánchez Alcázar.
Para esto, es necesario que la fosfatidilserina, grupo de fosfolípidos que normalmente mira hacia la cara interna de la célula, mire hacia el exterior.
Una señal que hace posible que las células apoptóticas sean devoradas de manera limpia y sin consecuencias para el conjunto del organismo.
Es por ello que la célula, según un trabajo previo de estos investigadores, desarrolla lo que se ha bautizado como el “ataúd celular”.
Una pared de microtúbulos, que se crea en el córtex celular, sosteniendo y protegiendo a la membrana de las células de la acción de las caspasas.
“Mientras dura el ataúd, las células apoptóticas mantienen su contenido que está siendo degradado dentro de las células, el tiempo suficiente para que otra célula vecina o un macrófago se la coma”, apunta Sánchez Alcázar.
Pero para que esto sea posible, como demuestran en este nuevo estudio, lo que hay entre la nueva pared de microtúbulos y la membrana debe permanecer vivo y funcionando con normalidad. “Es vida después de la muerte”, subraya este investigador.
En concreto, los científicos de la Universidad Pablo de Olavide han constatado en cultivos celulares que, gracias a este ataúd, el córtex celular se mantiene vivo.
Un trabajo en el que se ha comprobado la integridad de todas las proteínas que lo integran (las de sostén y adhesión celular, las reguladoras del calcio y el sodio…).
Una situación que permite, entre otras cosas, describir la hipótesis de la “fresh meat”, o carne fresca. Es decir, “gracias a este proceso, las otras células reconocen que las células apoptóticas han muerto recientemente y se encuentran en buen estado, la ven como un bocado apetitoso y se la comen, pudiendo ser reemplazada por otra en su lugar”, apunta Sánchez Alcázar.
Para esto, es necesario que la fosfatidilserina, grupo de fosfolípidos que normalmente mira hacia la cara interna de la célula, mire hacia el exterior.
Una señal que hace posible que las células apoptóticas sean devoradas de manera limpia y sin consecuencias para el conjunto del organismo.
El investigador José Antonio Sánchez Alcázar, arriba a la derecha, junto a su equipo de investigación. Fuente: UPO.
Posibles aplicaciones médicas
Para José Antonio Sánchez Alcázar este hallazgo abre nuevas líneas de trabajo, estableciendo campos de desarrollo para posibles aplicaciones médicas en áreas como el tratamiento del cáncer.
“Cuando se diseñan drogas, muchas veces la medicina intenta matar células y para ello hay que hacerlo del modo correcto si se quieren evitar efectos secundarios adversos. Es el caso de la quimioterapia, donde frecuentemente se busca que las células cancerosas mueran por apoptosis para evitar los efectos tóxicos e inflamatorios de la necrosis”, apunta este científico.
En este sentido, considera que “con estos descubrimientos podemos diseñar quimioterápicos que actúen de forma más eficiente y con menos efectos tóxicos secundarios”.
Otra línea de estudio sería, a partir de ahora, ver la posibilidad de conseguir que las células no tumorales evitaran la necrosis durante el tratamiento quimioterápico, disminuyendo de esta forma los efectos adversos sobre las células normales del organismo.
Para José Antonio Sánchez Alcázar este hallazgo abre nuevas líneas de trabajo, estableciendo campos de desarrollo para posibles aplicaciones médicas en áreas como el tratamiento del cáncer.
“Cuando se diseñan drogas, muchas veces la medicina intenta matar células y para ello hay que hacerlo del modo correcto si se quieren evitar efectos secundarios adversos. Es el caso de la quimioterapia, donde frecuentemente se busca que las células cancerosas mueran por apoptosis para evitar los efectos tóxicos e inflamatorios de la necrosis”, apunta este científico.
En este sentido, considera que “con estos descubrimientos podemos diseñar quimioterápicos que actúen de forma más eficiente y con menos efectos tóxicos secundarios”.
Otra línea de estudio sería, a partir de ahora, ver la posibilidad de conseguir que las células no tumorales evitaran la necrosis durante el tratamiento quimioterápico, disminuyendo de esta forma los efectos adversos sobre las células normales del organismo.
Referencia bibliográfica:
M Oropesa-Ávila, A Fernández-Vega, M de la Mata, J G Maraver, M D Cordero, D Cotán, M de Miguel, C P Calero, M V Paz, A D Pavón, M A Sánchez, A P Zaderenko, P Ybot-González y J A Sánchez-Alcázar. Apoptotic microtubules delimit an active caspase free area in the cellular cortex during the execution phase of apoptosis. Cell Death (2013). DOI: 10.1038/cddis.2013.58.
M Oropesa-Ávila, A Fernández-Vega, M de la Mata, J G Maraver, M D Cordero, D Cotán, M de Miguel, C P Calero, M V Paz, A D Pavón, M A Sánchez, A P Zaderenko, P Ybot-González y J A Sánchez-Alcázar. Apoptotic microtubules delimit an active caspase free area in the cellular cortex during the execution phase of apoptosis. Cell Death (2013). DOI: 10.1038/cddis.2013.58.