Fuente: ANU.
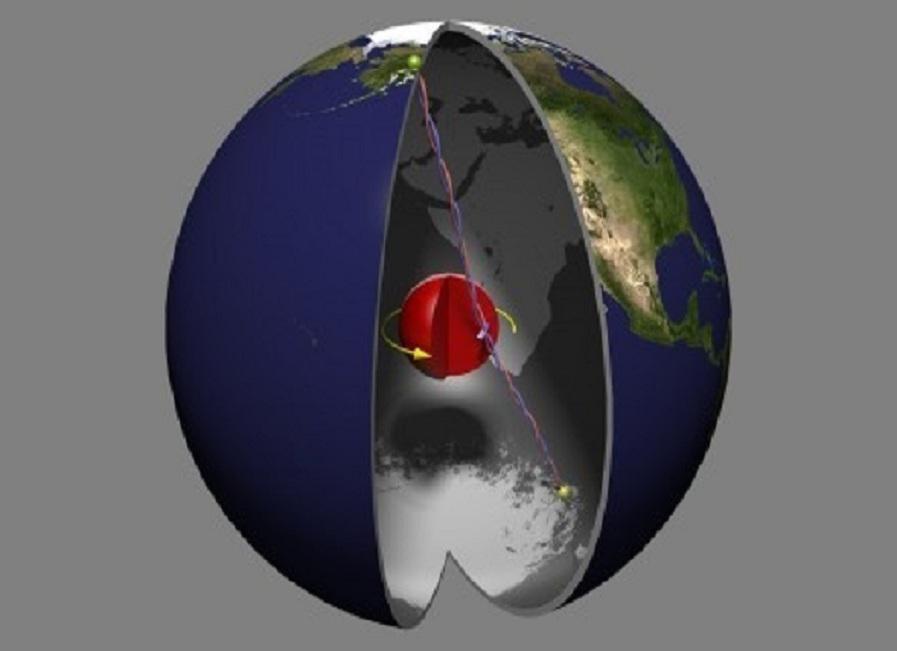
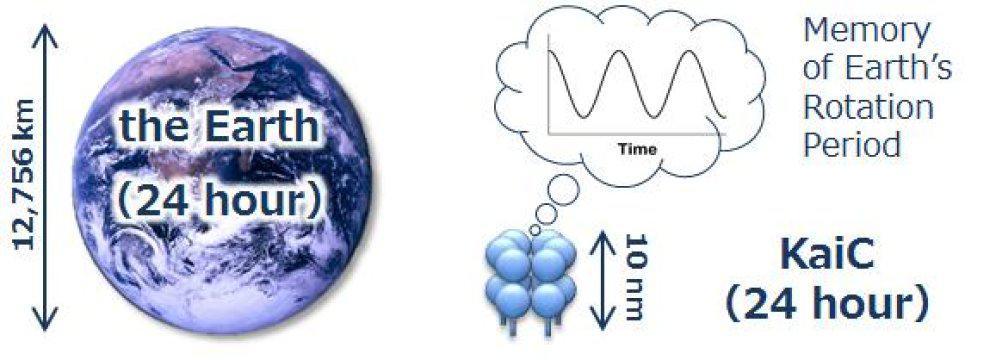
Un grupo de investigadores japoneses ha demostrado que el período de rotación diaria de la Tierra (24 horas) se codifica a nivel atómico en la proteína KaiC, una pequeña biomolécula de 10 nanómetros de diámetro que se expresa en las células de cianobacterias.
Los resultados de esta investigación, señala la nota de prensa de los Institutos Nacionales de Ciencias Naturales de Japón -recogida por EurekAlert! - (NINS) ayudarán a dilucidar una cuestión antigua en la cronobiología: ¿Cómo se determina el período circadiano de los relojes biológicos? Los resultados también ayudarán a comprender el mecanismo molecular básico del reloj biológico. Este conocimiento podría contribuir al desarrollo de terapias para trastornos asociados con los ritmos circadianos anormales.
Los resultados se dieron a conocer en línea ayer, en ScienceExpress, la versión electrónica de Science.
De acuerdo con los cambios diurnos en la naturaleza (en particular, de intensidad de luz y temperatura) que resultan de la rotación diaria de la Tierra alrededor de su eje, muchos organismos regulan sus actividades biológicas para garantizar la aptitud y eficiencia óptimas.
El reloj biológico se refiere al mecanismo que permite a los organismos ajustar el calendario de sus actividades biológicas. El período de este reloj se establece en aproximadamente 24 horas. Una amplia gama de estudios han investigado el reloj biológico en organismos que van desde las bacterias hasta los mamíferos. En consecuencia, la relación entre el reloj biológico y múltiples enfermedades está clara, pero no cómo se implementan los ritmos circadianos propiamente dichos.
El grupo de investigación abordó está esta pregunta utilizando cianobacterias. El reloj circadiano de las cianobacterias puede reconstruirse mediante la mezcla de tres proteínas reloj (Kaia, KaiB y KaiC) y ATP. Un estudio publicado en 2007 mostró que la actividad de la KaiC ATPasa, que media en la reacción de hidrólisis de ATP, está fuertemente asociada con la periodicidad circadiana. Los resultados de ese estudio indicaron que la estructura funcional de KaiC podría ser responsable de determinar el ritmo circadiano.
Resultados
La actividad de la KaiC ATPasa exhibe una sólida oscilación circadiana en presencia de las proteínas KaiA y Kaib. En el estudio reportado aquí, el perfil temporal de la actividad de la KaiC ATPasa exhibió un componente atenuante y oscilante, incluso en ausencia de Kaia y KaiB.
Un análisis detallado reveló que esta señal tuvo una frecuencia de 1/0,91 días, que aproximadamente coincide con el período de 24 horas. Por lo tanto, KaiC es la fuente de un ciclo constante que está en sintonía con la rotación diaria de la Tierra.
Para identificar los factores causales estructurales, se analizó KaiC utilizando alta resolución cristalográfica. Las estructuras atómicas resultantes revelaron la causa subyacente de la lentitud de KaiC en relación con otras ATPasas. Básicamente, la hidrólisis de ATP en esta proteína requiere una cantidad de energía notablemente mayor de lo que es habitual.
Los resultados de esta investigación, señala la nota de prensa de los Institutos Nacionales de Ciencias Naturales de Japón -recogida por EurekAlert! - (NINS) ayudarán a dilucidar una cuestión antigua en la cronobiología: ¿Cómo se determina el período circadiano de los relojes biológicos? Los resultados también ayudarán a comprender el mecanismo molecular básico del reloj biológico. Este conocimiento podría contribuir al desarrollo de terapias para trastornos asociados con los ritmos circadianos anormales.
Los resultados se dieron a conocer en línea ayer, en ScienceExpress, la versión electrónica de Science.
De acuerdo con los cambios diurnos en la naturaleza (en particular, de intensidad de luz y temperatura) que resultan de la rotación diaria de la Tierra alrededor de su eje, muchos organismos regulan sus actividades biológicas para garantizar la aptitud y eficiencia óptimas.
El reloj biológico se refiere al mecanismo que permite a los organismos ajustar el calendario de sus actividades biológicas. El período de este reloj se establece en aproximadamente 24 horas. Una amplia gama de estudios han investigado el reloj biológico en organismos que van desde las bacterias hasta los mamíferos. En consecuencia, la relación entre el reloj biológico y múltiples enfermedades está clara, pero no cómo se implementan los ritmos circadianos propiamente dichos.
El grupo de investigación abordó está esta pregunta utilizando cianobacterias. El reloj circadiano de las cianobacterias puede reconstruirse mediante la mezcla de tres proteínas reloj (Kaia, KaiB y KaiC) y ATP. Un estudio publicado en 2007 mostró que la actividad de la KaiC ATPasa, que media en la reacción de hidrólisis de ATP, está fuertemente asociada con la periodicidad circadiana. Los resultados de ese estudio indicaron que la estructura funcional de KaiC podría ser responsable de determinar el ritmo circadiano.
Resultados
La actividad de la KaiC ATPasa exhibe una sólida oscilación circadiana en presencia de las proteínas KaiA y Kaib. En el estudio reportado aquí, el perfil temporal de la actividad de la KaiC ATPasa exhibió un componente atenuante y oscilante, incluso en ausencia de Kaia y KaiB.
Un análisis detallado reveló que esta señal tuvo una frecuencia de 1/0,91 días, que aproximadamente coincide con el período de 24 horas. Por lo tanto, KaiC es la fuente de un ciclo constante que está en sintonía con la rotación diaria de la Tierra.
Para identificar los factores causales estructurales, se analizó KaiC utilizando alta resolución cristalográfica. Las estructuras atómicas resultantes revelaron la causa subyacente de la lentitud de KaiC en relación con otras ATPasas. Básicamente, la hidrólisis de ATP en esta proteína requiere una cantidad de energía notablemente mayor de lo que es habitual.
La Tierra y el reloj circadiano de la proteína KaiC. Fuente: IMS/NINS.
Periodo
El período del reloj circadiano es independiente de la temperatura ambiente, un fenómeno conocido como compensación de temperatura. Una molécula KaiC se compone de seis subunidades idénticas, cada una de las cuales contienen dominios duplicados con una serie de patrones de ATPasa.
La regulación asimétrica a escala atómica por el mecanismo antes mencionado dicta un mecanismo de retroalimentación que mantiene la actividad de la ATPasa en un nivel bajo constante.
Implicaciones tecnológicas
KaiC y otras moléculas de proteínas son capaces de moverse en escalas de tiempo cortas, del orden de la billonésima de segundo, hasta la décima de segundo.
Este estudio proporciona la primera demostración a nivel atómico de que las pequeñas moléculas de proteína pueden generar ritmos de 24 horas mediante la regulación de la estructura molecular y la reactividad.
Según los investigadores, el descubrimiento sugiere que los humanos y otros organismos complejos podrían compartir una maquinaria molecular similar. Asimismo, este mecanismo, que con muy poca energía mantiene el ritmo, puede inspirar el desarrollo de procesos de reacción química altamente eficientes y sostenibles y procesado de información basados en sistemas moleculares.
En la investigación participaron la Universidad de Nagoya y el Instituto Universitario de Osaka de Investigación en Proteínas, entre otros centros.
El período del reloj circadiano es independiente de la temperatura ambiente, un fenómeno conocido como compensación de temperatura. Una molécula KaiC se compone de seis subunidades idénticas, cada una de las cuales contienen dominios duplicados con una serie de patrones de ATPasa.
La regulación asimétrica a escala atómica por el mecanismo antes mencionado dicta un mecanismo de retroalimentación que mantiene la actividad de la ATPasa en un nivel bajo constante.
Implicaciones tecnológicas
KaiC y otras moléculas de proteínas son capaces de moverse en escalas de tiempo cortas, del orden de la billonésima de segundo, hasta la décima de segundo.
Este estudio proporciona la primera demostración a nivel atómico de que las pequeñas moléculas de proteína pueden generar ritmos de 24 horas mediante la regulación de la estructura molecular y la reactividad.
Según los investigadores, el descubrimiento sugiere que los humanos y otros organismos complejos podrían compartir una maquinaria molecular similar. Asimismo, este mecanismo, que con muy poca energía mantiene el ritmo, puede inspirar el desarrollo de procesos de reacción química altamente eficientes y sostenibles y procesado de información basados en sistemas moleculares.
En la investigación participaron la Universidad de Nagoya y el Instituto Universitario de Osaka de Investigación en Proteínas, entre otros centros.
Referencia bibliográfica:
Jun Abe, Takuya B. Hiyama, Atsushi Mukaiyama, Seyoung Son, Toshifumi Mori, Shinji Saito, Masato Osako, Julie Wolanin, Eiki Yamashita, Takao Kondo, y Shuji Akiyama: Atomic-scale origins of slowness in the cyanobacterial circadian clock. Science (2015). DOI: 10.1126/science.1261040.
Jun Abe, Takuya B. Hiyama, Atsushi Mukaiyama, Seyoung Son, Toshifumi Mori, Shinji Saito, Masato Osako, Julie Wolanin, Eiki Yamashita, Takao Kondo, y Shuji Akiyama: Atomic-scale origins of slowness in the cyanobacterial circadian clock. Science (2015). DOI: 10.1126/science.1261040.