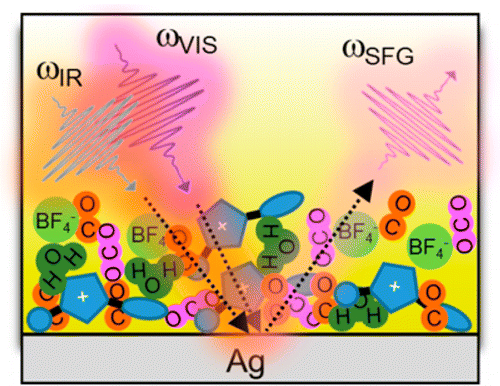
El proceso que se produce en la celda. Imagen: N. G. Rey/D. Dlott. Fuente: American Chemical Society.
El dióxido de carbono es uno de los gases que contribuyen al efecto invernadero, y científicos de todo el mundo tratan de usar este exceso de dióxido de carbono en la atmósfera, convirtiéndolo en combustibles como etanol o metanol, y así eliminar la dependencia del petróleo.
Uno de los carburantes ya usados en aviación es el Sintegas, o gas de síntesis, compuesto por monóxido de carbono e hidrógeno. El monóxido de carbono se puede obtener a partir de la electro-reducción del dióxido de carbono, que se realiza aplicando energía eléctrica en una celda química, similar a una pila.
Al contrario que en una batería, en vez de obtener electricidad de una reacción química, en este caso; se aplica un voltaje (energía eléctrica) y al introducir el dióxido de carbono, se obtiene el producto químico deseado: monóxido de carbono.
Sin embargo, la conversión del dióxido de carbono en otro producto no es muy favorable energéticamente por ser una molécula muy estable. Por lo tanto, sigue siendo uno de los retos de la comunidad científica: Encontrar un catalizador o unas condiciones (presión, temperatura) en las que la electro-reducción del dióxido de carbono se pueda producir a gran escala y a bajo coste energético.
En 2011, un grupo de ingenieros químicos de la empresa Dioxide Materials en colaboración con un grupo de la Universidad de Illinois (Urbana-Champaign, EE.UU.) presentaron una novedosa celda de combustible, en la que a partir del dióxido de carbono se obtenía una gran selectividad en la conversión en monóxido de carbono (es decir, que éste era el producto obtenido mayoritariamente) a voltajes muy bajos.
Esta celda electroquímica estaba compuesta por electrodos de difusión de gas, nanopartículas de platino y plata, un electrolito compuesto de un líquido iónico (EMIM-BF4) y agua. En un artículo publicado en la revista Science, explicaron que el líquido iónico formaba un complejo con el dióxido de carbono, permitiendo la electro-reducción a voltajes más bajos. Este descubrimiento abría una nueva puerta hacia la producción a gran escala de estas celdas.
Uno de los carburantes ya usados en aviación es el Sintegas, o gas de síntesis, compuesto por monóxido de carbono e hidrógeno. El monóxido de carbono se puede obtener a partir de la electro-reducción del dióxido de carbono, que se realiza aplicando energía eléctrica en una celda química, similar a una pila.
Al contrario que en una batería, en vez de obtener electricidad de una reacción química, en este caso; se aplica un voltaje (energía eléctrica) y al introducir el dióxido de carbono, se obtiene el producto químico deseado: monóxido de carbono.
Sin embargo, la conversión del dióxido de carbono en otro producto no es muy favorable energéticamente por ser una molécula muy estable. Por lo tanto, sigue siendo uno de los retos de la comunidad científica: Encontrar un catalizador o unas condiciones (presión, temperatura) en las que la electro-reducción del dióxido de carbono se pueda producir a gran escala y a bajo coste energético.
En 2011, un grupo de ingenieros químicos de la empresa Dioxide Materials en colaboración con un grupo de la Universidad de Illinois (Urbana-Champaign, EE.UU.) presentaron una novedosa celda de combustible, en la que a partir del dióxido de carbono se obtenía una gran selectividad en la conversión en monóxido de carbono (es decir, que éste era el producto obtenido mayoritariamente) a voltajes muy bajos.
Esta celda electroquímica estaba compuesta por electrodos de difusión de gas, nanopartículas de platino y plata, un electrolito compuesto de un líquido iónico (EMIM-BF4) y agua. En un artículo publicado en la revista Science, explicaron que el líquido iónico formaba un complejo con el dióxido de carbono, permitiendo la electro-reducción a voltajes más bajos. Este descubrimiento abría una nueva puerta hacia la producción a gran escala de estas celdas.
Airbus 320. Fuente: Airbus (2012).

El experimento
Ahora, para entender la reacción producida en esta celda química de combustible, fisicoquímicos de la Universidad de Illinois han estudiado la mitad de la celda (cátodo) donde se produce la electro-reducción del dióxido de carbono. Esta reacción ocurre en la superficie entre el electrodo de plata y el electrolito de líquido iónico y agua con dióxido de carbono disuelto.
Para caracterizar la superficie de la plata cubierta por el líquido, es necesario el uso de una técnica óptica, porque sólo los fotones pueden penetrar en el líquido sin modificarlo. Cualquier técnica basada en electrones no se puede usar, porque sólo pueden viajar en el vacío.
La técnica usada se llama sum frequency generation (generación de la suma de las frecuencias) porque consiste en detectar la suma de las frecuencias, y se produce cuando dos pulsos de luz de frecuencia infrarroja y visible se superponen en la muestra en el mismo lugar y tiempo.
Se necesitan láseres ultracortos, es decir, pulsos de luz coherente muy energéticos que iluminan la muestra durante un tiempo tan corto como el que la luz tarda en viajar una distancia tan pequeña como el diámetro de un pelo. Uno de los haces de luz es infrarrojo, siendo resonante con un estado de vibración de la molécula que se quiera detectar en la superficie.
Las vibraciones moleculares son propiedades intrínsecas de cada molécula, en otras palabras: sus huellas dactilares. Por lo tanto, la sum frequency generation en sincronización con otra técnicas electroquímicas (cyclic voltammetry, voltametría cíclica), permite observar en tiempo real y en el lugar, cómo cambian las moléculas en la superficie de la plata cuando se perturba el ambiente, en este caso el voltaje de la superficie.
'Película'
Básicamente, los investigadores han hecho una película de cómo se organizan las moléculas del líquido iónico cuando la electro-reducción del dióxido de carbono se está produciendo. En particular se observaron dos efectos: cómo la orientación de las moléculas del líquido iónico en la superficie controla la electro-reducción de dióxido de carbono, y que el monóxido de carbono es producido en el electrodo y no lo contamina.
Este descubrimiento es un avance en la ciencia fundamental y un conocimiento esencial para el progreso y desarrollo de una nueva celda. Hay muy pocos laboratorios en el mundo que dispongan de esta tecnología y que hagan este tipo de experimentos en sistemas tan complejos (por no decir casi el único).
Los resultados han sido portada de The Journal of Physical Chemistry C, y el proyecto ha sido financiado por Air Force Office of Scientific Research, de la Fuerza Aérea estadounidense, y National Science Foundation.
*Natalia García Rey es una de las autoras del artículo publicado ahora, y pertenece al grupo de Dana D. Dlott -el investigador principal-, del Departamento de Química de la Universidad de Illinois.
Ahora, para entender la reacción producida en esta celda química de combustible, fisicoquímicos de la Universidad de Illinois han estudiado la mitad de la celda (cátodo) donde se produce la electro-reducción del dióxido de carbono. Esta reacción ocurre en la superficie entre el electrodo de plata y el electrolito de líquido iónico y agua con dióxido de carbono disuelto.
Para caracterizar la superficie de la plata cubierta por el líquido, es necesario el uso de una técnica óptica, porque sólo los fotones pueden penetrar en el líquido sin modificarlo. Cualquier técnica basada en electrones no se puede usar, porque sólo pueden viajar en el vacío.
La técnica usada se llama sum frequency generation (generación de la suma de las frecuencias) porque consiste en detectar la suma de las frecuencias, y se produce cuando dos pulsos de luz de frecuencia infrarroja y visible se superponen en la muestra en el mismo lugar y tiempo.
Se necesitan láseres ultracortos, es decir, pulsos de luz coherente muy energéticos que iluminan la muestra durante un tiempo tan corto como el que la luz tarda en viajar una distancia tan pequeña como el diámetro de un pelo. Uno de los haces de luz es infrarrojo, siendo resonante con un estado de vibración de la molécula que se quiera detectar en la superficie.
Las vibraciones moleculares son propiedades intrínsecas de cada molécula, en otras palabras: sus huellas dactilares. Por lo tanto, la sum frequency generation en sincronización con otra técnicas electroquímicas (cyclic voltammetry, voltametría cíclica), permite observar en tiempo real y en el lugar, cómo cambian las moléculas en la superficie de la plata cuando se perturba el ambiente, en este caso el voltaje de la superficie.
'Película'
Básicamente, los investigadores han hecho una película de cómo se organizan las moléculas del líquido iónico cuando la electro-reducción del dióxido de carbono se está produciendo. En particular se observaron dos efectos: cómo la orientación de las moléculas del líquido iónico en la superficie controla la electro-reducción de dióxido de carbono, y que el monóxido de carbono es producido en el electrodo y no lo contamina.
Este descubrimiento es un avance en la ciencia fundamental y un conocimiento esencial para el progreso y desarrollo de una nueva celda. Hay muy pocos laboratorios en el mundo que dispongan de esta tecnología y que hagan este tipo de experimentos en sistemas tan complejos (por no decir casi el único).
Los resultados han sido portada de The Journal of Physical Chemistry C, y el proyecto ha sido financiado por Air Force Office of Scientific Research, de la Fuerza Aérea estadounidense, y National Science Foundation.
*Natalia García Rey es una de las autoras del artículo publicado ahora, y pertenece al grupo de Dana D. Dlott -el investigador principal-, del Departamento de Química de la Universidad de Illinois.
Referencias bibliográficas:
Natalia García Rey y Dana D. Dlott: Structural Transition in an Ionic Liquid Controls CO2 Electrochemical Reduction. The Journal of Physical Chemistry C (2015). DOI: 10.1021/acs.jpcc.5b03397.
A. Rosen et al.: Ionic Liquid Mediated Selective Conversion of CO2 to CO at Low Overpotentials. Science (2011). DOI: 10.1126/science.1209786.
Natalia García Rey y Dana D. Dlott: Structural Transition in an Ionic Liquid Controls CO2 Electrochemical Reduction. The Journal of Physical Chemistry C (2015). DOI: 10.1021/acs.jpcc.5b03397.
A. Rosen et al.: Ionic Liquid Mediated Selective Conversion of CO2 to CO at Low Overpotentials. Science (2011). DOI: 10.1126/science.1209786.