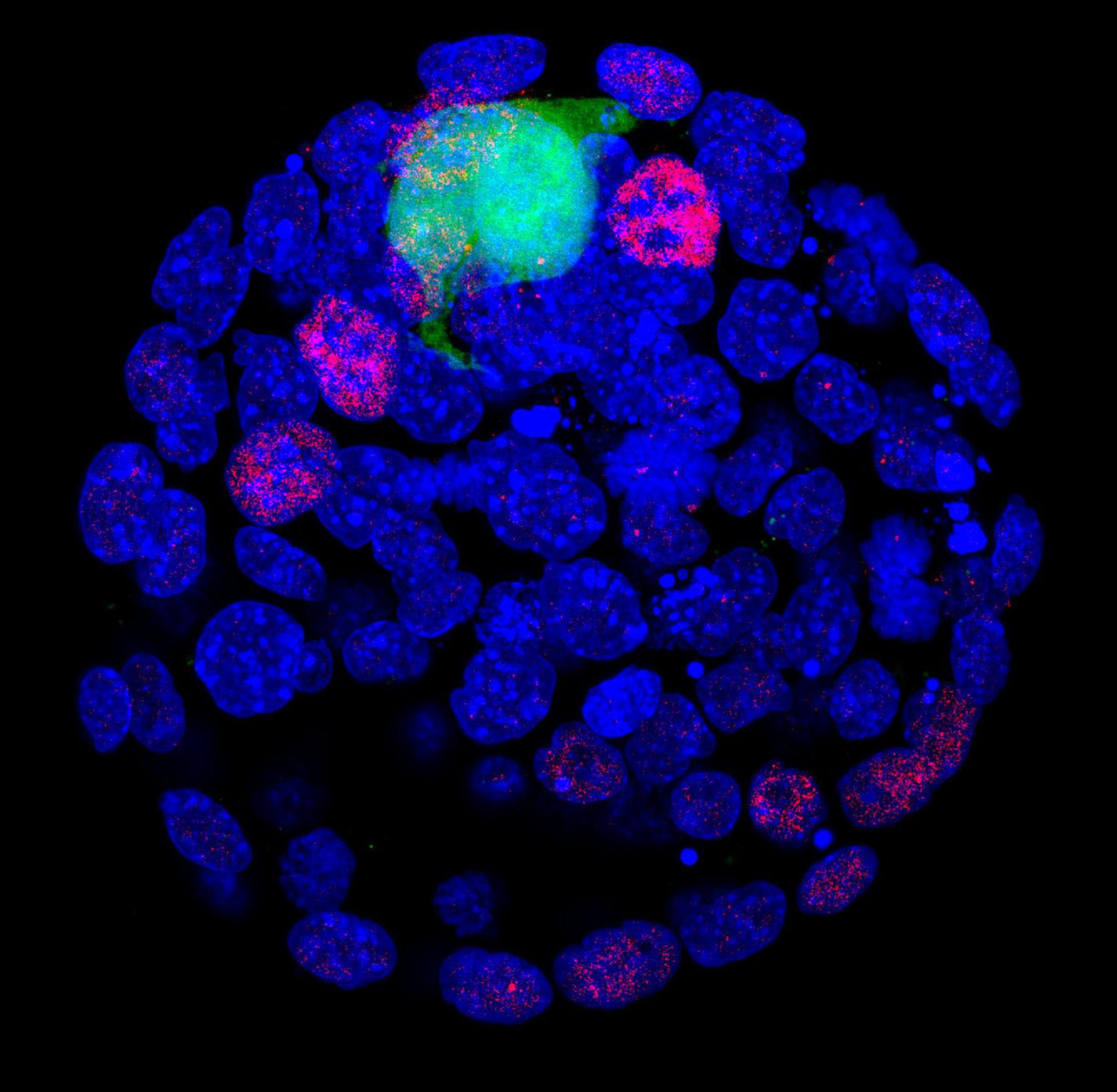
Células madres pluripotentes (verde) en el epiblasto (rojo) de un embrión de ratón en día 3,5 de gestación (azul). Fuente: UGR.
Un equipo internacional de científicos, en el que participa la Universidad de Granada, ha aportado nuevos datos desconocidos hasta la fecha sobre las células madre pluripotentes, una alternativa muy prometedora para el tratamiento de distintas enfermedades humanas y en especial para enfermedades inducidas por daño o degeneración de los tejidos tales como Alzheimer, Parkinson o infarto cerebral.
Las células madre pluripotentes no pueden formar un organismo completo, pero sí cualquier otro tipo de célula correspondiente a los tres linajes embrionarios, por lo que pueden regenerar cualquier célula y tejido de un organismo.
El trabajo, que publica la prestigiosa revista Cell Reports, revela conexiones funcionales muy importantes entre la regulación epigenética del genoma humano, las rutas de señalización celular y el fenómeno de heterogeneidad intercelular en células madre pluripotentes.
Así, este estudio contribuye a una mejor compresión de las transiciones de linaje celular y revela aspectos desconocidos hasta ahora sobre la biología de células madre, contribuyendo así al desarrollo de distintas aplicaciones de dichas células en terapias humanas.
David Landeira Frías, investigador del departamento de Ciencias de la Computación e Inteligencia Artificial y uno de los autores de este artículo, apunta en la nota de prensa de la universidad que recientes avances en el campo de la biomedicina “permiten reprogramar de manera artificial células del cuerpo de un organismo adulto a un estado de pluripotencia similar al encontrado durante el desarrollo embrionario temprano”.
Las células madre pluripotentes no pueden formar un organismo completo, pero sí cualquier otro tipo de célula correspondiente a los tres linajes embrionarios, por lo que pueden regenerar cualquier célula y tejido de un organismo.
El trabajo, que publica la prestigiosa revista Cell Reports, revela conexiones funcionales muy importantes entre la regulación epigenética del genoma humano, las rutas de señalización celular y el fenómeno de heterogeneidad intercelular en células madre pluripotentes.
Así, este estudio contribuye a una mejor compresión de las transiciones de linaje celular y revela aspectos desconocidos hasta ahora sobre la biología de células madre, contribuyendo así al desarrollo de distintas aplicaciones de dichas células en terapias humanas.
David Landeira Frías, investigador del departamento de Ciencias de la Computación e Inteligencia Artificial y uno de los autores de este artículo, apunta en la nota de prensa de la universidad que recientes avances en el campo de la biomedicina “permiten reprogramar de manera artificial células del cuerpo de un organismo adulto a un estado de pluripotencia similar al encontrado durante el desarrollo embrionario temprano”.
Diferencias de comportamiento
“Una de las grandes barreras para la aplicación segura y exitosa de esta tecnología a entornos clínicos es la naturaleza heterogénea de las poblaciones de células madre; variaciones funcionales entre células de una misma población generan grandes diferencias en su comportamiento que podría conllevar el fallo de la terapia, e incluso el desarrollo de nuevas enfermedades”, advierte el investigador de la UGR.
Las denominadas variaciones célula-célula ocurren en células con el mismo genoma y, por tanto, es muy probable que los modulares epigenéticos tengan un papel crítico en la generación de la heterogeneidad funcional.
Mediante el uso de técnicas punteras en epigenómica, el laboratorio de David Landeira en el Centro de Genómica e Investigación Oncológica (Pfizer-Junta de Andalucía-UGR), en colaboración con el laboratorio de Amanda Fisher, del MRC-Clinical Science Centre en Reino Unido, han analizado la función de un regulador epigenético (Jarid2) en la creación de variabilidad intercelular en poblaciones de células madre pluripotentes.
Los resultados de la investigación muestran que Jarid2 “es un factor esencial para que las células pluripotentes mantengan una interacción adecuada con las células de su entorno y puedan así llevar a cabo procesos de diferenciación celular de manera eficiente y coordinada”.
Además, los científicos han demostrado que Jarid2 regula la heterogeneidad y función de las células pluripotentes a través de rutas de señalización tradicionalmente implicadas en diversos tipos de cáncer, por lo que el estudio también es relevante en el contexto de esta enfermedad.
Órganos de sustitución
Recientemente, un equipo de científicos del Salk Institute de La Jolla (California, EEUU), en colaboración, entre otros, con investigadores del Hospital Clínic de Barcelona, la Universidad Católica de Murcia y la Clínica CEMTRO de Madrid han hallado un tipo de células madre caracterizadas por su ubicación en el embrión (específicas de una zona concreta de este) que son capaces de convertirse en cualquier tipo de tejido y que proliferan en laboratorio mejor que las otras.
Bautizadas como “células madre pluripotentes de región selectiva” (rsPSCs, por sus siglas en inglés), las células halladas presentan unas características que hacen posible su producción a gran escala e incluso su alteración genética (editando su ADN celular). Ambas posibilidades son cruciales para las terapias de sustitución celular, y la regeneración de órganos.
“Una de las grandes barreras para la aplicación segura y exitosa de esta tecnología a entornos clínicos es la naturaleza heterogénea de las poblaciones de células madre; variaciones funcionales entre células de una misma población generan grandes diferencias en su comportamiento que podría conllevar el fallo de la terapia, e incluso el desarrollo de nuevas enfermedades”, advierte el investigador de la UGR.
Las denominadas variaciones célula-célula ocurren en células con el mismo genoma y, por tanto, es muy probable que los modulares epigenéticos tengan un papel crítico en la generación de la heterogeneidad funcional.
Mediante el uso de técnicas punteras en epigenómica, el laboratorio de David Landeira en el Centro de Genómica e Investigación Oncológica (Pfizer-Junta de Andalucía-UGR), en colaboración con el laboratorio de Amanda Fisher, del MRC-Clinical Science Centre en Reino Unido, han analizado la función de un regulador epigenético (Jarid2) en la creación de variabilidad intercelular en poblaciones de células madre pluripotentes.
Los resultados de la investigación muestran que Jarid2 “es un factor esencial para que las células pluripotentes mantengan una interacción adecuada con las células de su entorno y puedan así llevar a cabo procesos de diferenciación celular de manera eficiente y coordinada”.
Además, los científicos han demostrado que Jarid2 regula la heterogeneidad y función de las células pluripotentes a través de rutas de señalización tradicionalmente implicadas en diversos tipos de cáncer, por lo que el estudio también es relevante en el contexto de esta enfermedad.
Órganos de sustitución
Recientemente, un equipo de científicos del Salk Institute de La Jolla (California, EEUU), en colaboración, entre otros, con investigadores del Hospital Clínic de Barcelona, la Universidad Católica de Murcia y la Clínica CEMTRO de Madrid han hallado un tipo de células madre caracterizadas por su ubicación en el embrión (específicas de una zona concreta de este) que son capaces de convertirse en cualquier tipo de tejido y que proliferan en laboratorio mejor que las otras.
Bautizadas como “células madre pluripotentes de región selectiva” (rsPSCs, por sus siglas en inglés), las células halladas presentan unas características que hacen posible su producción a gran escala e incluso su alteración genética (editando su ADN celular). Ambas posibilidades son cruciales para las terapias de sustitución celular, y la regeneración de órganos.
Referencia bibliográfica:
Landeira et al.: Jarid2 Coordinates Nanog Expression and PCP/Wnt Signaling Required for Efficient ESC Differentiation and Early Embryo Development. Cell Reports (2015). DOI: 10.1016/j.celrep.2015.06.060.
Landeira et al.: Jarid2 Coordinates Nanog Expression and PCP/Wnt Signaling Required for Efficient ESC Differentiation and Early Embryo Development. Cell Reports (2015). DOI: 10.1016/j.celrep.2015.06.060.